研究还结合 空间转录组技术,将单细胞状态与组织微环境“原位”对应,清晰展示了肿瘤前沿、感染区域及健康组织中各类中性粒细胞的功能定位,为免疫研究开启空间化新时代。
BD 单细胞平台助力这一顶级成果,充分展现其在大规模整合、高分辨率免疫解析中的行业领先性能。

英文题目Architecture of the neutrophil compartment
中文题目中性粒细胞区室的构建
发表期刊Nature
发表时间2025.12
DOIhttps://doi.org/10.1038/s41586-025-09807-0
研究背景
中性粒细胞是数量最多的先天免疫细胞,其传统“短寿单一”的观点已被推翻。近年研究发现,它们在感染、肿瘤等不同组织中展现出显著的功能可塑性(如免疫调节、促血管生成)。
然而,由于多数研究局限于特定组织或疾病,几个核心问题尚未解决:
中性粒细胞究竟有多少种可定义的状态?
这些状态之间是否存在统一的组织结构与转化轨迹?
疾病如何重塑这些状态?
哪些关键信号决定其命运分化?
此外,中性粒细胞寿命短、易活化,传统技术难以系统捕捉其全程动态,缺乏跨组织、跨疾病的统一参考图谱,也限制了其在诊断与治疗中的应用。
为此,本研究通过整合大规模单细胞测序、空间转录组与多组学分析,构建了一个全局性的“中性粒细胞图谱(NeuMap)”,旨在系统揭示其状态架构、动态轨迹与调控机制


研究思路
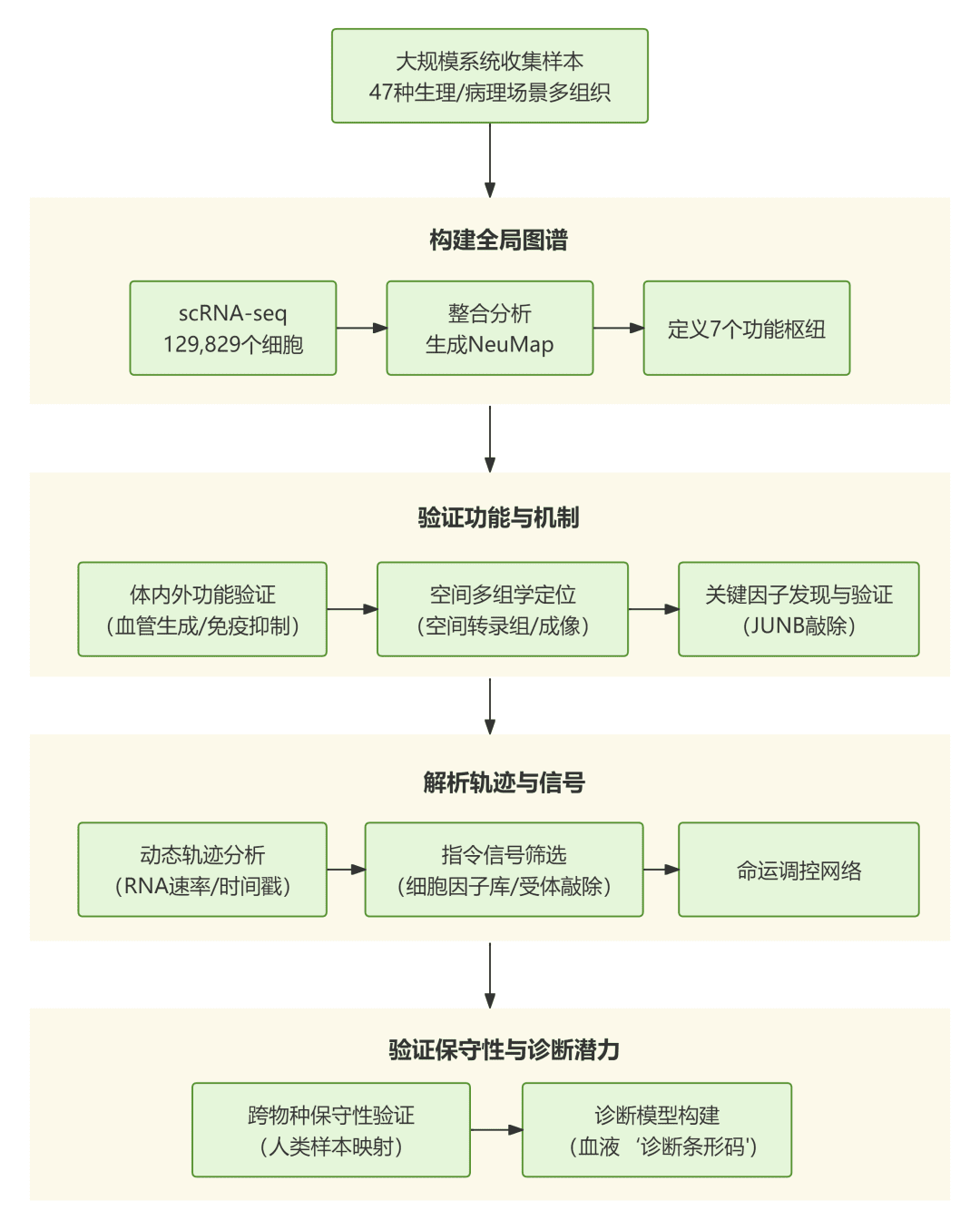
第1阶段:构建全局中性粒细胞转录图谱(NeuMap)
通过单细胞RNA测序(scRNA-seq)对47种不同解剖、生理及病理场景(涵盖健康、感染、炎症、癌症等)下的小鼠中性粒细胞进行转录组分析,共整合129,829个细胞。利用降维与聚类技术,构建了一个互联的转录图谱(NeuMap),揭示了中性粒细胞并非分散的群体,而是形成一个连续、统一的转录结构。图谱中定义了七个功能枢纽(Hubs),包括前体样、未成熟、免疫静默、干扰素应答、两个免疫抑制/促血管生成以及抗原呈递枢纽。
第2阶段:验证NeuMap的功能与空间定位预测
通过体外与体内实验验证图谱预测。例如,分离肺、肝脏等组织的CD14+ Ptgs2+ 中性粒细胞(IS-I枢纽),证实其具有更强的促血管生成和抑制T细胞杀伤的能力。利用空间转录组和多色荧光成像,展示不同枢纽的中性粒细胞在组织(如肿瘤边缘、感染灶周围)中具有特异的微解剖定位。通过构建中性粒细胞特异性JunB基因敲除小鼠,证实转录因子AP-1(尤其是JUNB)是调控IS-I枢纽免疫抑制和促血管生成功能的关键分子开关。
第3阶段:解析状态转换的动力学轨迹与调控信号
利用RNA速率分析和时间戳追踪实验,描绘了中性粒细胞在健康、炎症和癌症状态下截然不同的成熟与分化轨迹。结合体外细胞因子筛选(86种细胞因子)和培养验证,发现TGFβ、IFNβ和GM-CSF是分别驱动细胞向成熟、干扰素应答和癌症相关状态分化的关键指令性信号。通过构建相应的受体条件性敲除小鼠,在体内证实这些信号通路对特定枢纽的形成至关重要。
第4阶段:探索图谱的保守性与诊断应用潜力
将人类多个组织(健康与疾病)的中性粒细胞单细胞数据投射到小鼠NeuMap上,发现核心枢纽结构在人与小鼠间高度保守。进一步证明,仅通过分析外周血中性粒细胞在NeuMap上的分布模式,即可构建具有高分辨率的诊断“条形码”,能够区分年龄、妊娠、不同肿瘤类型及感染状态等多种宿主病理生理状况,展现了其作为无创诊断工具的潜力。
研究发现
Figure 1:构建全局中性粒细胞转录图谱(NeuMap)
成功构建首个跨多组织/疾病的中性粒细胞全局单细胞图谱(NeuMap),揭示其转录状态构成一个连续统一体,并划分为七个功能特异的功能枢纽。

● a图(示意图):展示了构建NeuMap所使用的实验设计,包括采集自不同发育阶段、性别、年龄以及健康与疾病(如癌症、感染、炎症)共47种条件下,来自13个组织的中性粒细胞进行单细胞测序。
● b图(UMAP,按组织着色):将所有细胞投射到二维的UMAP图上,并用颜色标注其组织来源。结果显示,不同组织的细胞在图谱中占据不同但相互连接的区域,直观展示了组织微环境对中性粒细胞状态的影响。
● c图(功能特征评分图):将代表特定生物学过程(如增殖、血管生成、免疫抑制等)的基因集评分投射到NeuMap上。颜色越暖表示该区域细胞表达该特征基因越多。结果揭示了不同功能模块在图谱中的空间分布。
● d图(UMAP,按健康/疾病着色):用颜色区分细胞来源于健康还是疾病状态。结果显示,疾病状态的细胞(如肿瘤、感染)主要从健康状态所在的区域“延伸”出去,而非创造全新的、分离的集群。
● e图(枢纽示意图):基于无偏聚类和功能分析,将NeuMap划分为七个核心的功能枢纽,并标注了每个枢纽的定义性标志基因和核心功能预测(如“PreNeu”枢纽与增殖相关,“IS-I”枢纽与免疫抑制/血管生成相关)。
● f图(堆叠条形图):量化展示了不同组织和病理条件下,细胞分布在这七个枢纽中的比例。该图证实了枢纽与生理病理背景的特异性关联,例如肿瘤样本中富含“IS-II”枢纽的细胞。
Figure 2:验证NeuMap的功能预测与空间定位
实验证实NeuMap的功能预测准确;JUNB是调控免疫抑制/促血管生成状态的关键因子;不同枢纽细胞在组织中有特异性空间定位。
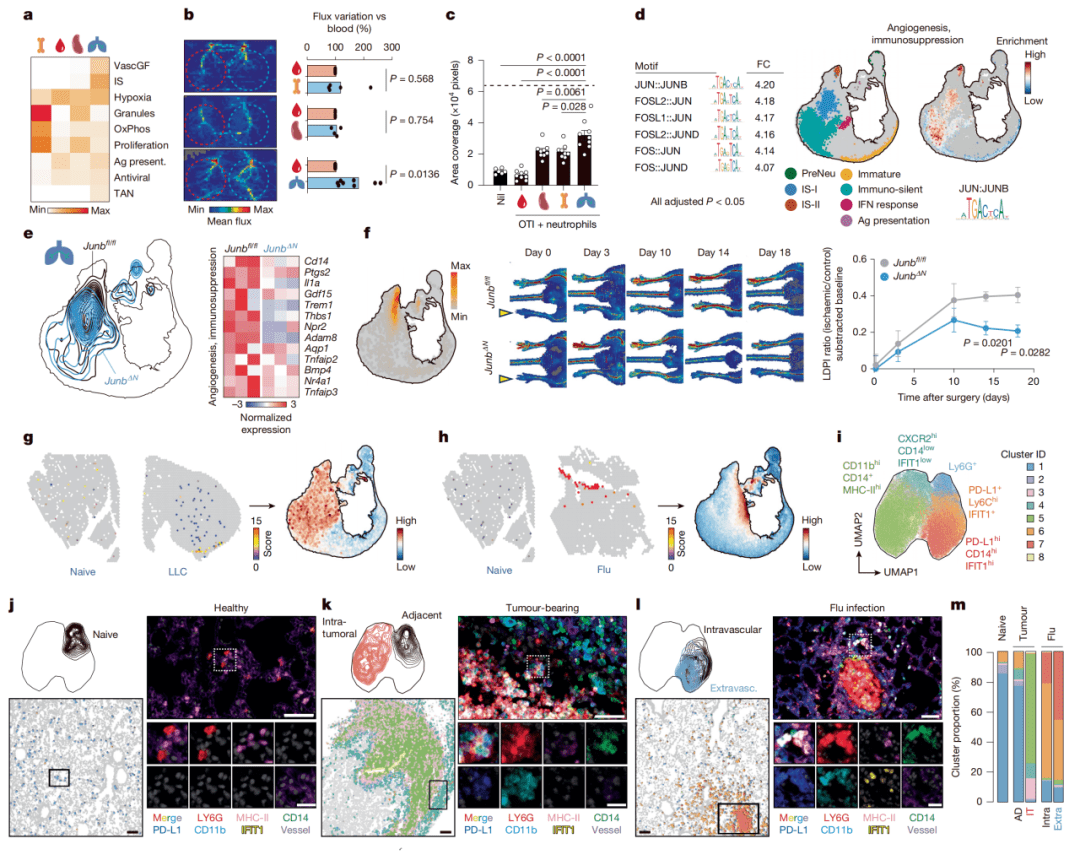
● a-c图(功能验证):a图热图显示,肺来源的中性粒细胞在免疫抑制和血管生成基因特征上评分最高。b图体内基质胶栓实验和c图体外T细胞抑制实验证实,肺中性粒细胞(富集于IS-I枢纽)确实具有最强的促血管新生能力和免疫抑制活性。
● d图(分子机制):通过联合测序技术(Dogma-seq)分析染色质可及性,发现IS-I枢纽区域富集AP-1(如JUNB)、SMAD等转录因子的结合基序,提示这些因子调控该枢纽的功能。
● e-f图(基因敲除验证):构建中性粒细胞特异性 Junb 敲除小鼠(JunbΔN)。e图显示敲除后肺中性粒细胞在NeuMap上的分布发生改变。f图证明在下肢缺血模型中,JunbΔN小鼠的血管再生功能受损。
● g-m图(空间验证):利用空间转录组(g-h图)和多色循环免疫荧光(i-m图)技术,在组织原位进行验证。结果清晰显示,干扰素应答枢纽的中性粒细胞聚集在流感感染灶周围,而免疫抑制/促血管生成枢纽(IS-II)的细胞则富集于肿瘤边缘区域,证明了状态与微环境的精准匹配。
Figure 3:解析中性粒细胞的动态轨迹与命运分支
中性粒细胞遵循可预测的轨迹在枢纽间转换;健康、癌症、炎症状态偏好截然不同的路径分支,表明疾病重编程了其命运。
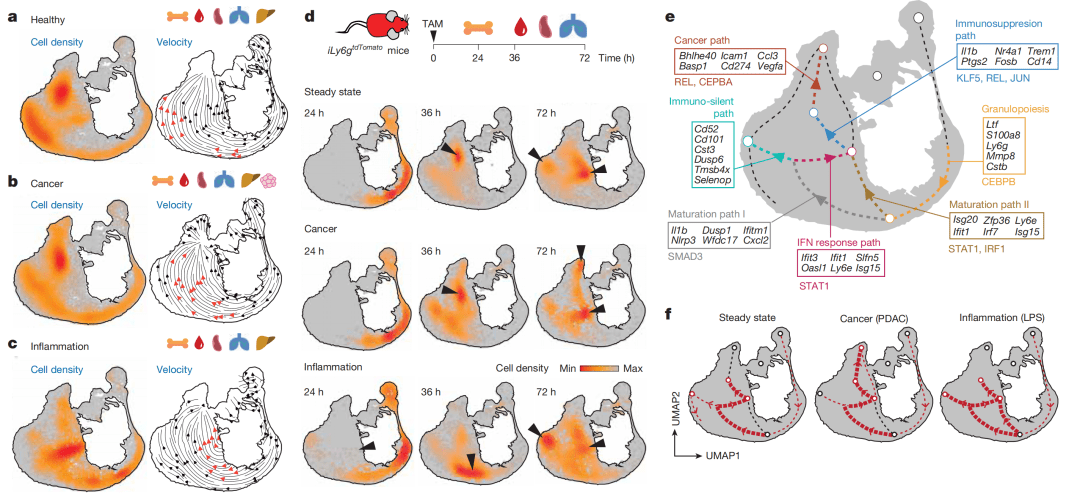
● a-c图(状态特异性轨迹):分别展示了健康、肿瘤(PDAC)和炎症(LPS)小鼠的中性粒细胞在NeuMap上的密度分布(背景颜色),并叠加了RNA速率分析预测的细胞运动方向(箭头)。结果显示:健康状态下,细胞主要从未成熟枢纽流向免疫静默枢纽;肿瘤状态下,流向免疫抑制枢纽(IS-I/II);炎症状态下,则强烈流向干扰素应答枢纽。
● d图(时间戳追踪):利用 Ly6g-tdTomato 小鼠进行脉冲标记,追踪新产生的中性粒细胞随时间的分布变化。结果直观证实了细胞从骨髓释放后,会随时间迁移并进入不同的功能枢纽,动态验证了轨迹的存在。
● e图(轨迹网络模型):综合上述分析,构建了一个轨迹网络模型,概括出三条主要路径,并标注了每条路径上特异性激活的基因和转录因子。
● f图(轨迹偏好总结图):以示意图形式总结了三种主要生理病理状态下,中性粒细胞在NeuMap中最可能遵循的路径。
Figure 4:鉴定驱动命运分化的指令性信号
TGFβ、IFNβ、GM-CSF是指令性细胞因子,分别驱动细胞向成熟静默、抗病毒炎症、癌相关免疫抑制状态分化。
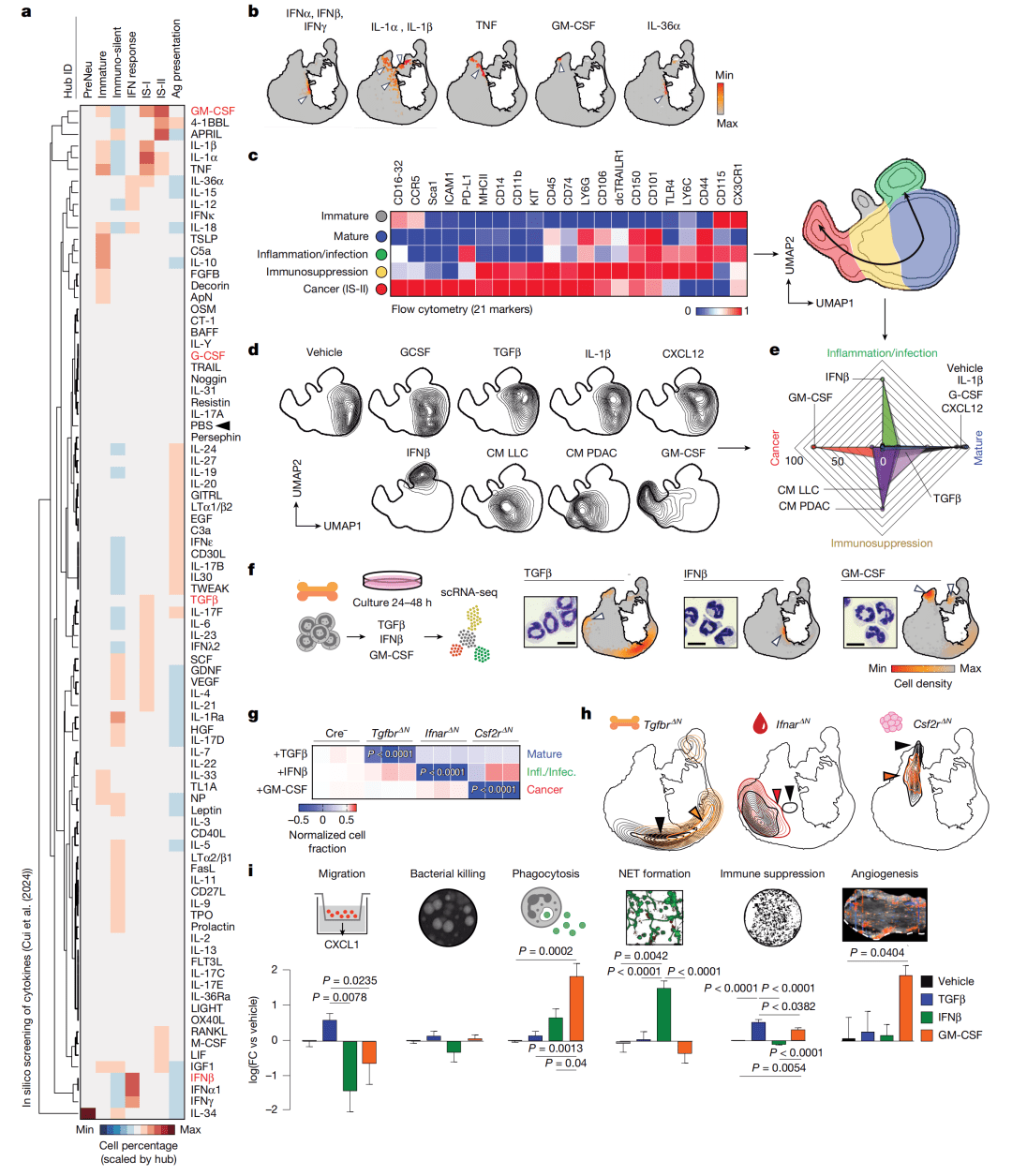
● a-b图(细胞因子筛选):将已发表的、经86种细胞因子处理的中性粒细胞数据投射到NeuMap上。a图热图显示不同细胞因子诱导的细胞富集于不同枢纽。b图直观展示,例如IFNβ将细胞推向干扰素应答枢纽,GM-CSF推向IS-II枢纽。
● c-e图(体外验证与表型分析):用不同细胞因子处理骨髓来源中性粒细胞,并通过21色流式细胞术分析。c图UMAP和热图定义了5个表型群。d-e图证实TGFβ诱导成熟表型,IFNβ诱导炎症表型,GM-CSF和肿瘤条件培养基诱导癌症相关/免疫抑制表型。
● f-h图(遗传学验证):利用受体敲除小鼠(Tgfbr2ΔN, IfnarΔN, Csf2rΔN)进行验证。f图显示敲除细胞无法在体外响应相应细胞因子。g-h图表明,在体内,敲除相应受体后,中性粒细胞在NeuMap中的分布发生预期偏移(如Csf2rΔN小鼠的肿瘤中性粒细胞减少向IS-II枢纽的迁移)。
● i图(功能输出汇总):汇总显示,不同细胞因子诱导的状态具有独特的功能谱,如GM-CSF处理的细胞表现出强免疫抑制和促血管生成能力,但迁移能力弱。
Figure 5:验证NeuMap的跨物种保守性与诊断潜力
NeuMap枢纽结构在人类中高度保守;仅分析外周血中性粒细胞在图谱上的分布,即可生成高区分度的诊断“条形码”。
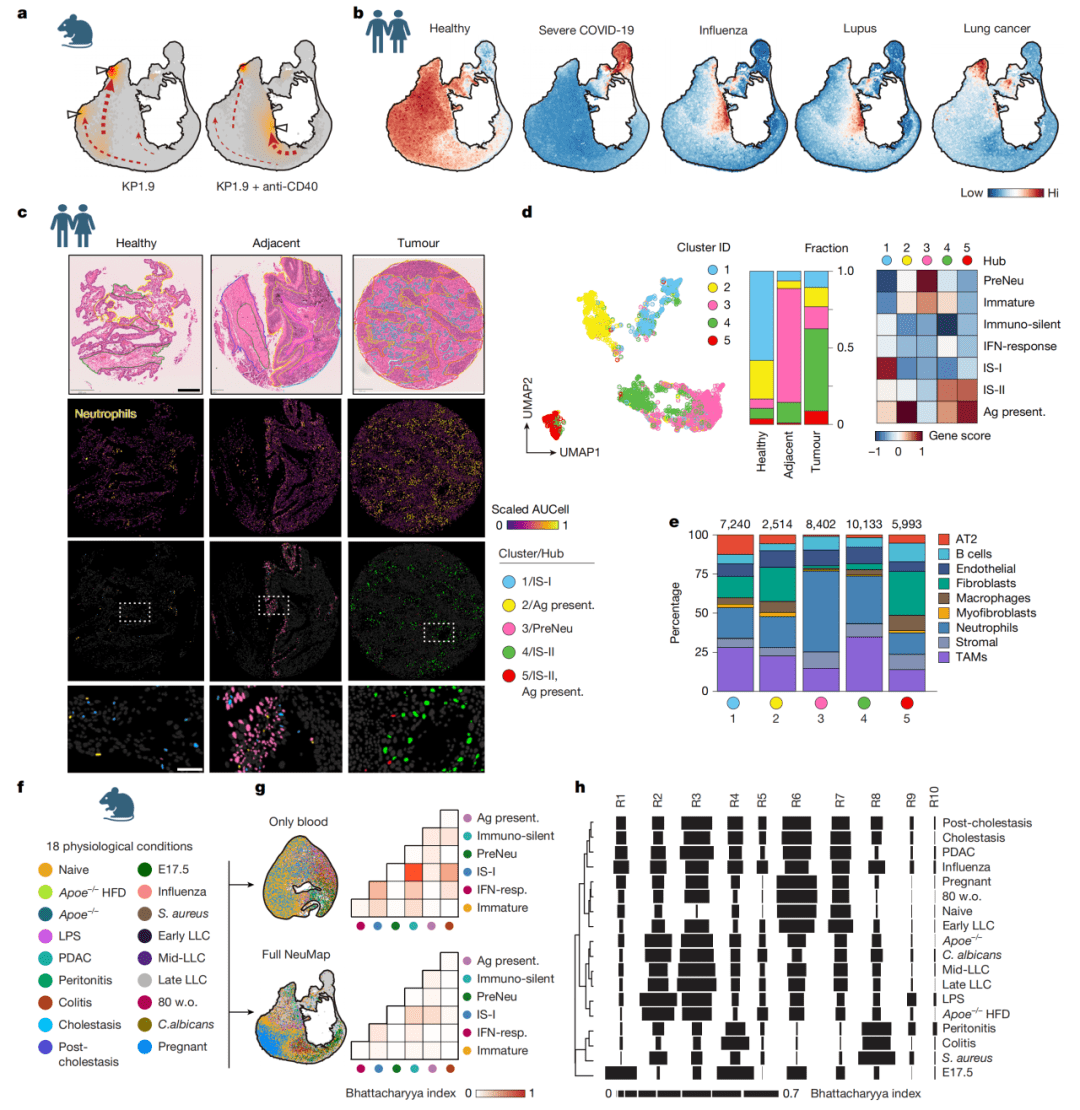
● a-b图(治疗响应与人类疾病映射):a图显示,对免疫治疗有响应的肺癌小鼠,其中性粒细胞从促癌的IS-II枢纽向抗病毒的干扰素应答枢纽转移。b图将人类患者(重症COVID-19、流感、狼疮、肺癌)的中性粒细胞特征投射到小鼠NeuMap上,成功定位到对应枢纽,证明了跨物种保守性。
● c-e图(人类空间转录组验证):对肺癌患者的组织进行高分辨率空间转录组分析。c图展示肿瘤、癌旁、健康区域。d图鉴定出5类人类中性粒细胞簇,其转录特征与小鼠枢纽对应。e图显示不同簇的细胞与特定的基质细胞(如癌细胞、成纤维细胞)空间共定位。
● f-h图(血液诊断“条形码”):f图概述了从18种不同条件(如不同癌症、感染、年龄)小鼠采集血样。g图证明将血液细胞投射到完整NeuMap(而非仅血液数据)能极大提高区分度。h图通过计算细胞在10个诊断区域的分布重叠度,为每种条件生成了独一无二的“诊断条形码”,能有效区分例如早期与晚期癌症、不同类型感染等。
参考文献:
Cerezo-Wallis, Daniela, et al. “Architecture of the Neutrophil Compartment.” Nature, 3 Dec. 2025, pp. 1-66, https://doi.org/10.1038/s41586-025-09807-0.
![]() 科研之路,与您同行
科研之路,与您同行
![]() 若有所获,欢迎点赞、推荐与分享
若有所获,欢迎点赞、推荐与分享

