• 创新靶点发现:Lgals3在AKI患者及模型中显著高表达,其缺失可减轻肾损伤,而过表达则加剧病变。
• 机制深度解析:通过CLIP-seq等技术,首次证实Lgals3通过结合 Nr4a1基因3’UTR的AAUAAA序列,激活下游转录因子Bap1,驱动铁死亡通路。
• 治疗突破:设计靶向AAUAAA的ASO寡核苷酸药物,成功阻断Lgals3-Nr4a1轴,显著缓解动物模型肾损伤,为AKI提供全新治疗策略。
瑞兴生物为本研究提供RNA-seq、CLIP-seq等关键技术,助力精准解析Lgals3的RNA结合图谱和下游靶基因。
互作研究,就找瑞兴生物,专业高效,值得信赖!
原文概览

中文标题:RNA 结合蛋白 Lgals3、铁死亡与急性肾损伤
期刊:Journal of the American Society of Nephrology
影响因子IF:10.3
发表时间:2025.2.10
DOI:10.1681/ASN.0000000638
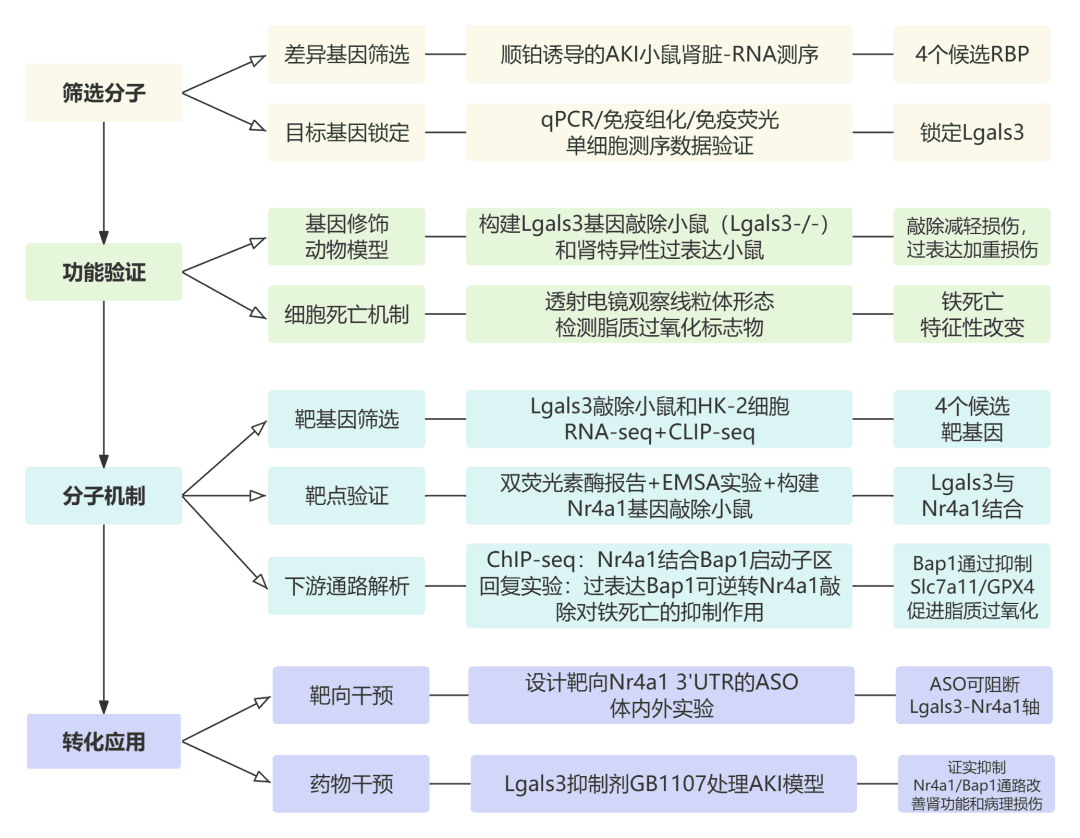
技术路线
主要结果
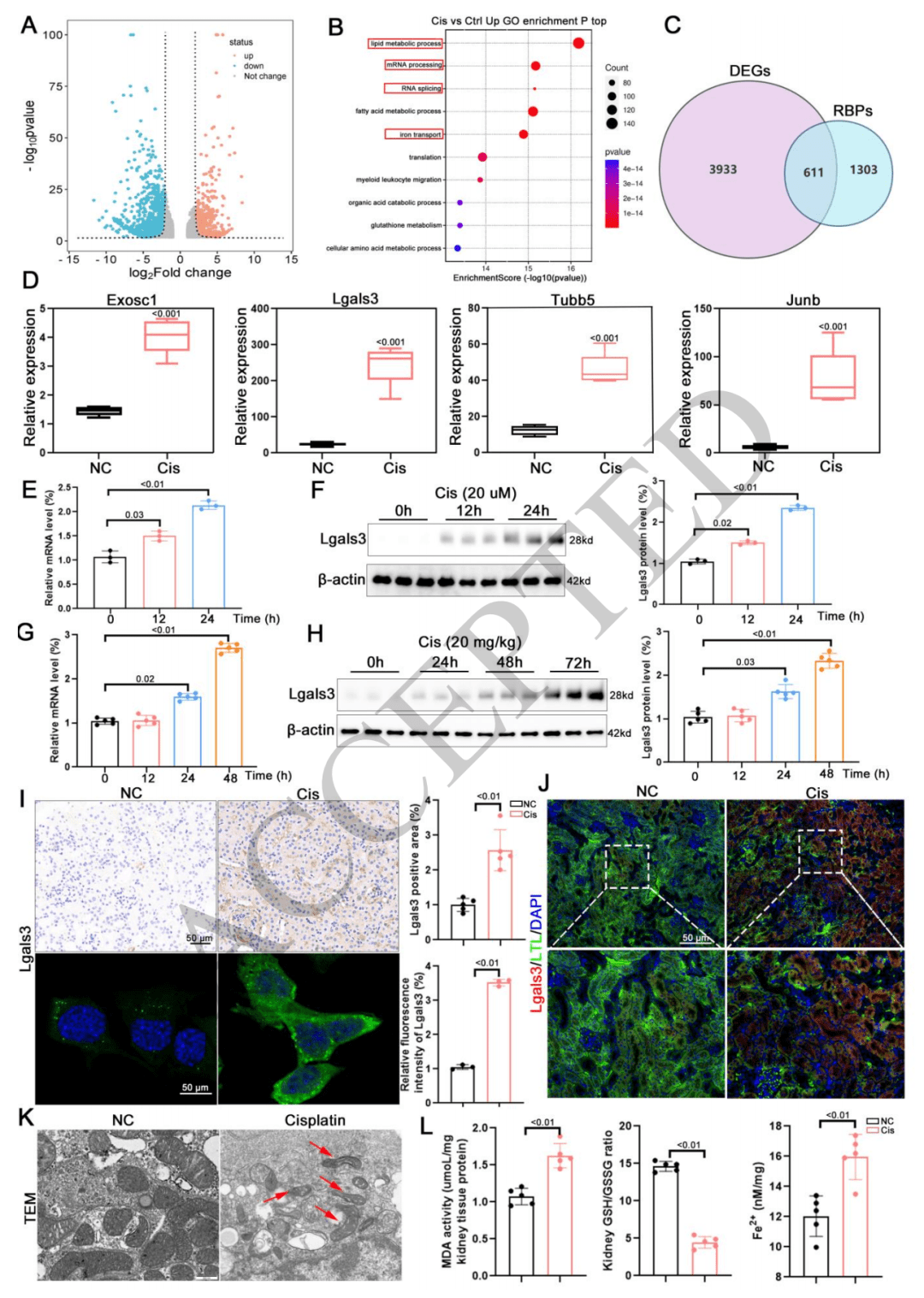
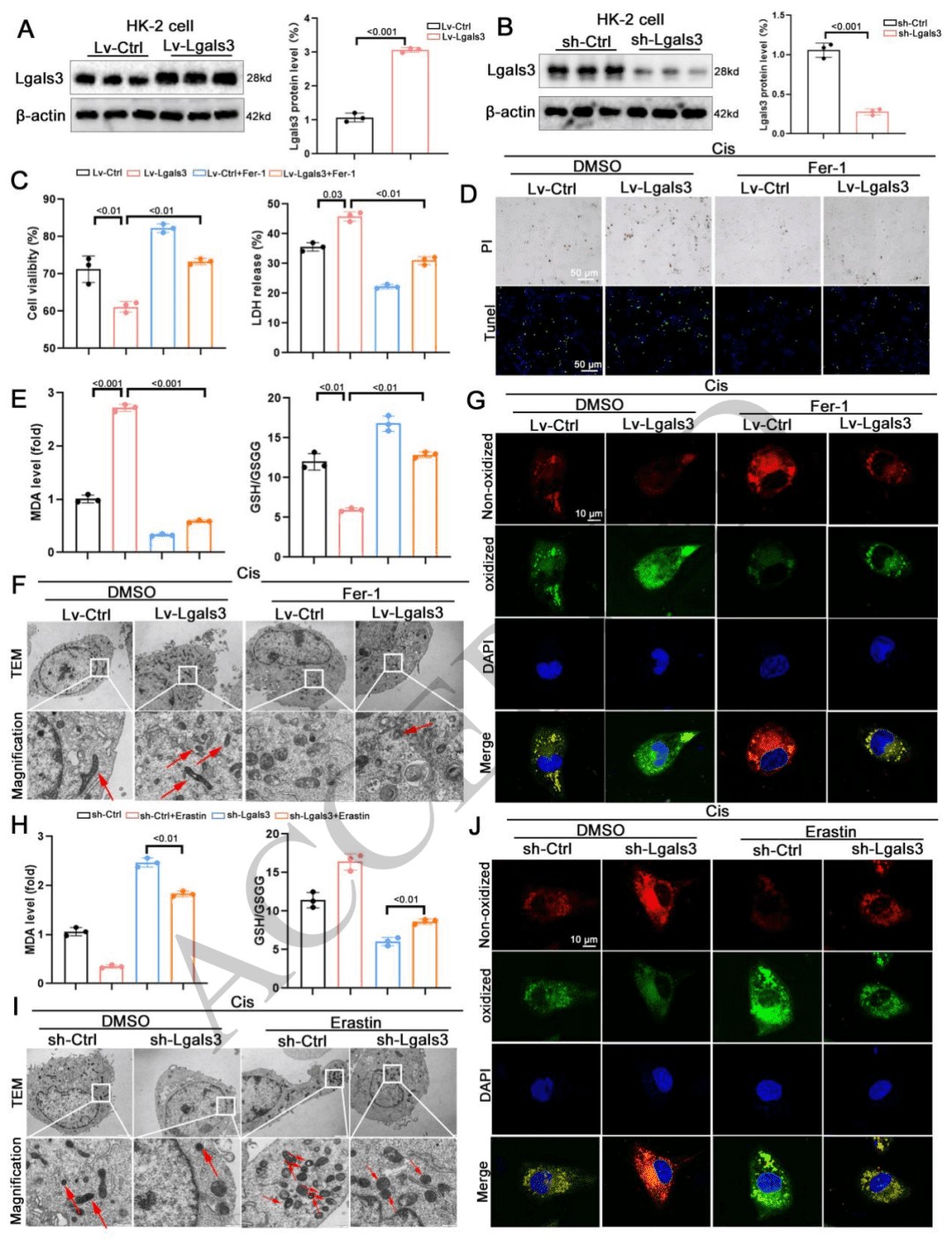
与铁死亡相关:通过对基因表达谱的分析(如 RNA 测序、KEGG 分析、GSEA 分析等),发现差异表达基因(DEGs)主要富集在与铁死亡相关的通路中。同时,电镜观察到肾脏线粒体形态改变,且关键铁死亡标志物(MDA、GSH 和 Fe 2+ )水平变化证实了铁死亡的发生。这一系列结果表明,Lgals3 表达变化与 AKI 过程中的铁死亡密切相关 。
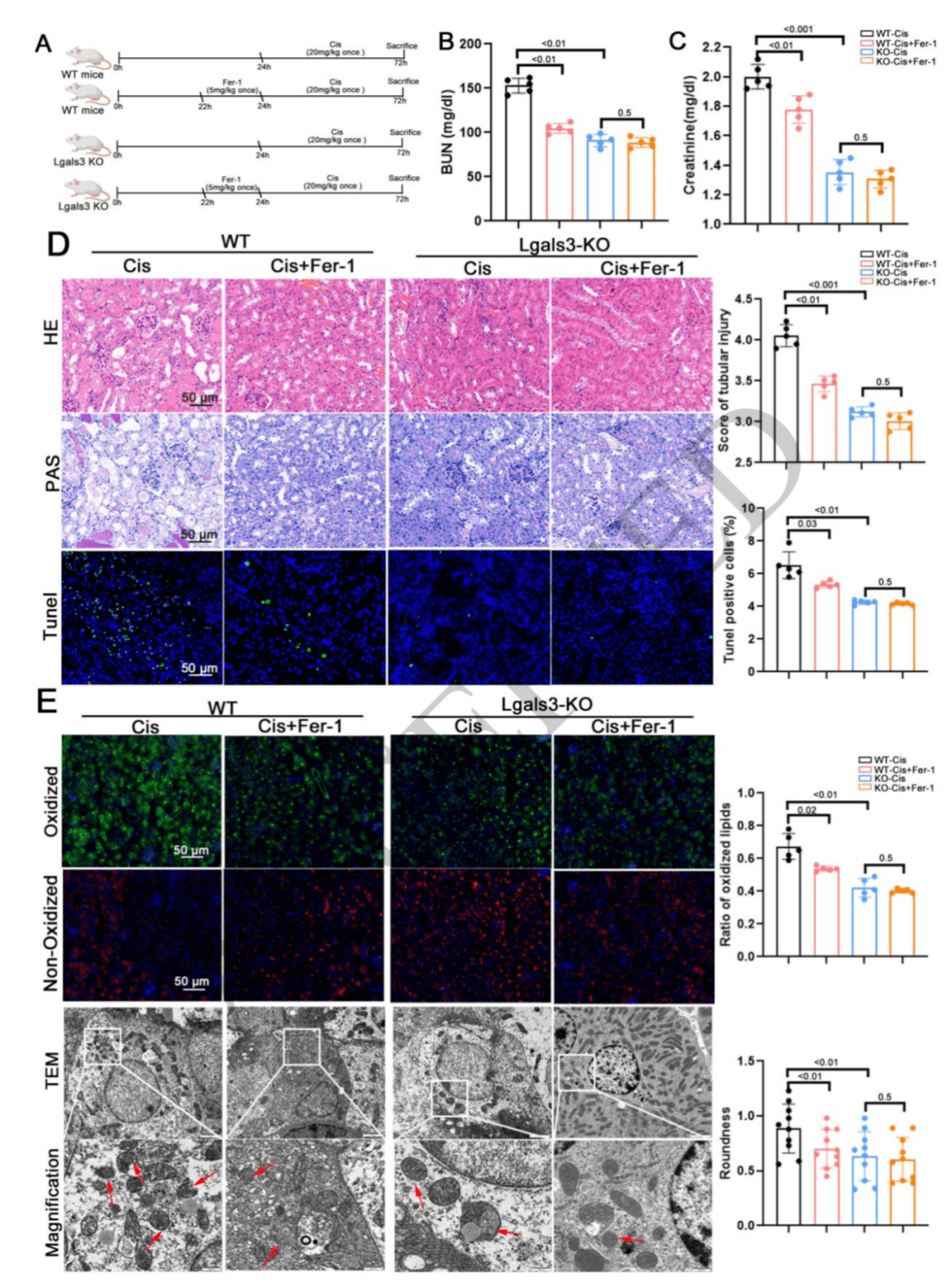
作用机制为激活铁死亡:在构建的体内 AKI 模型中,通过实验观察到 Lgals3 基因敲除可显著减少脂质过氧化的积累和线粒体皱缩数量的增加,而 Lgals3 过表达则出现相反现象。同时,使用铁死亡抑制剂 Fer-1 处理后,能缓解由 Lgals3 过表达或顺铂诱导的肾脏损伤。这些结果说明,Lgals3 在体内加剧肾脏损伤的作用机制是激活铁死亡。
03 体外实验中,Lgals3通过促进铁死亡加剧了肾脏损伤
通过促进铁死亡实现:从铁死亡相关指标来看,过表达 Lgals3 时,细胞内脂质过氧化产物 MDA 水平上升、抗氧化物质 GSH 水平下降,线粒体损伤加剧且脂质过氧化积累增多;敲低 Lgals3 或使用铁死亡抑制剂 Fer-1 处理后,这些铁死亡相关指标得到改善。此外,使用铁死亡激活剂 erastin 进一步验证,敲低 Lgals3 能抑制 erastin 诱导的铁死亡。这些结果充分说明 Lgals3 在体外通过推动铁死亡进程,进而加剧肾脏损伤。
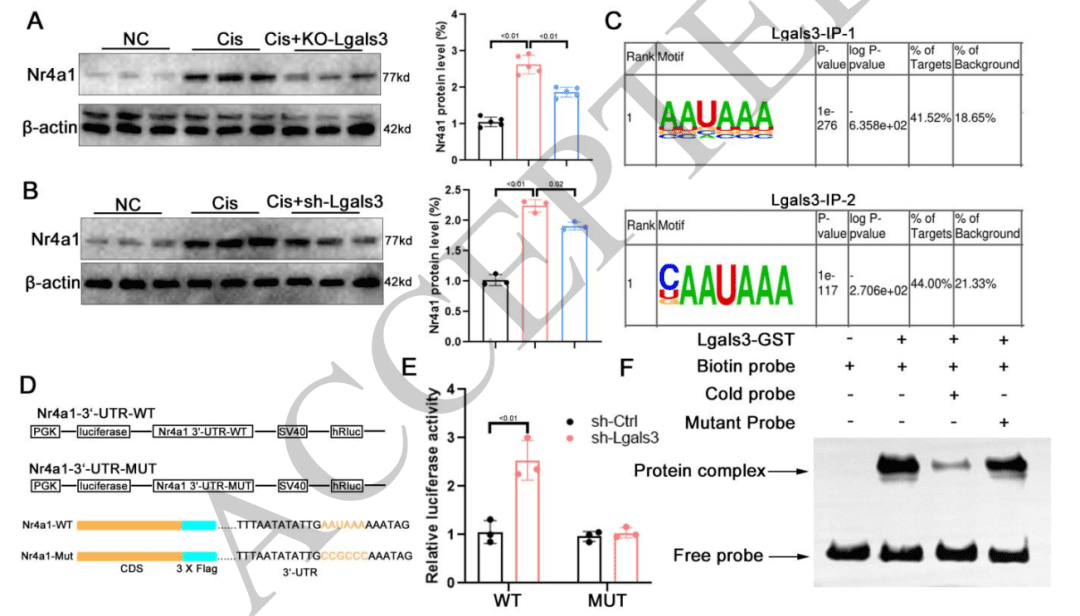
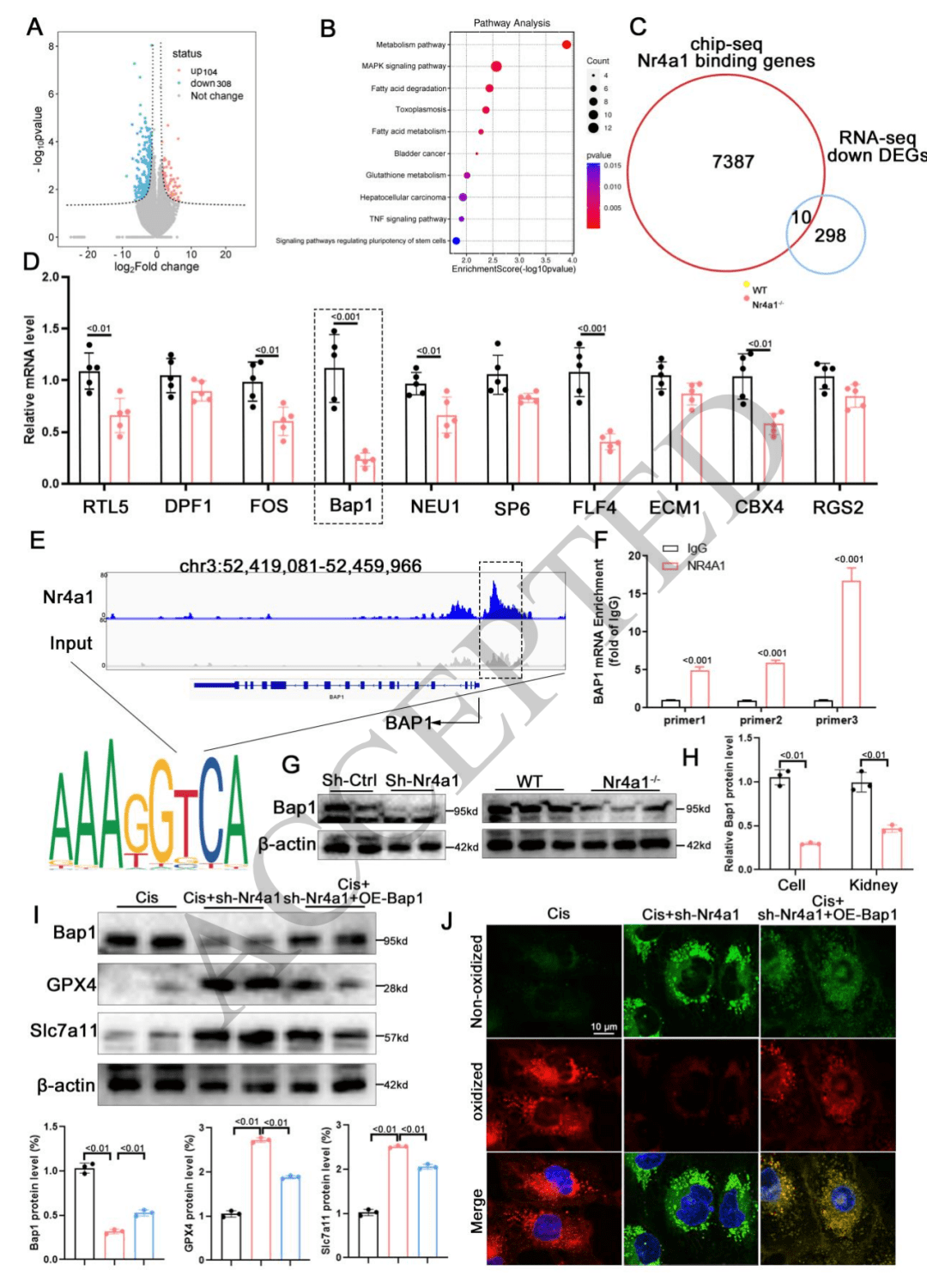
确定靶标 Nr4a1:将 Lgals3 结合的基因与 Lgals3 敲除小鼠肾脏和 HK-2 细胞中的差异表达基因整合分析,筛选出 4 个共同基因,其中 Nr4a1 在顺铂处理下表达显著变化,且受 Lgals3 敲除的影响明显。进一步通过结合峰分析、双荧光素酶报告实验和电泳迁移率变动分析(EMSA)等实验,证实 Lgals3 能够与 Nr4a1 的 3’UTR 区域结合,从而确定 Nr4a1 是 Lgals3 的作用靶标。
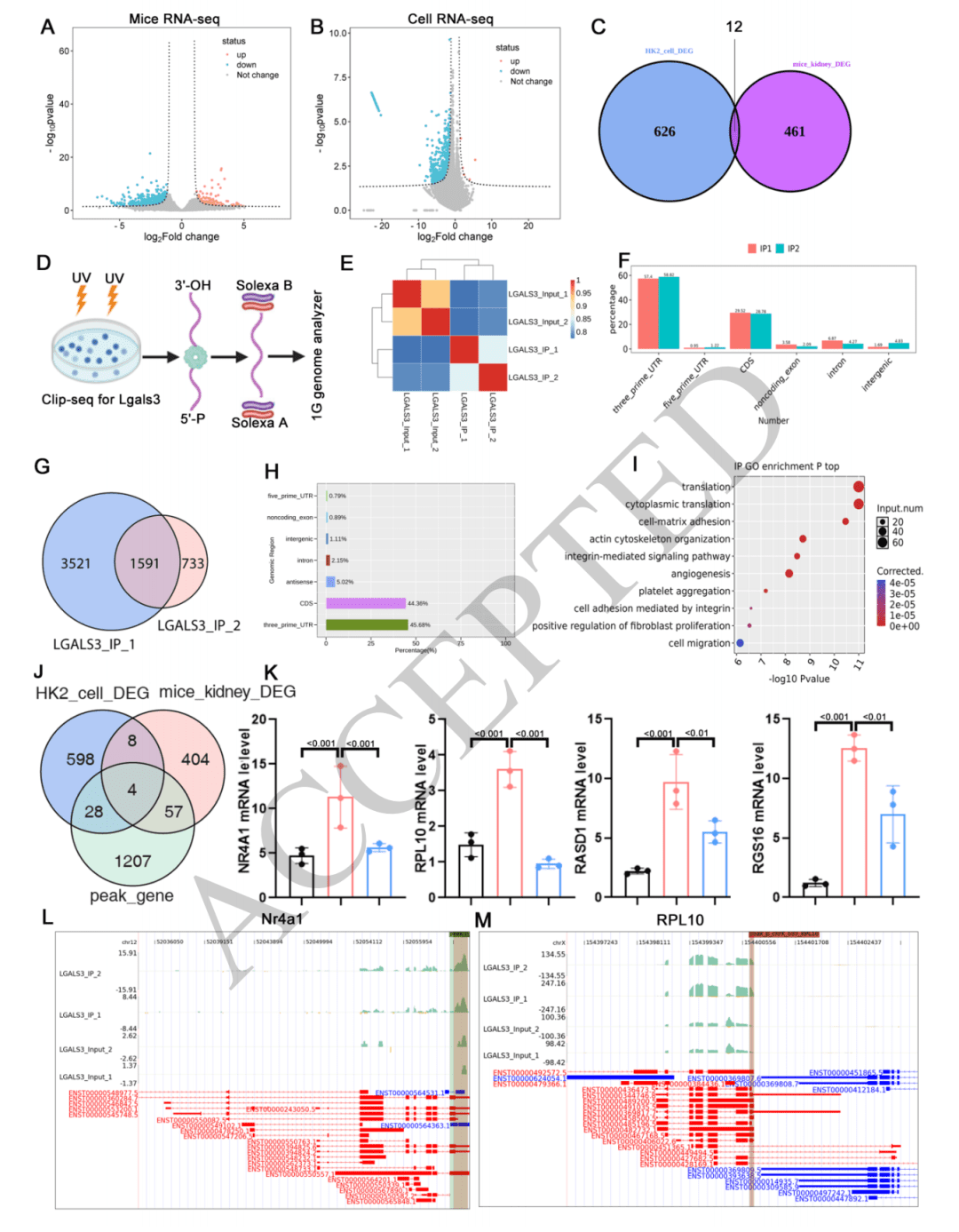
05 Lgals3通过AAUAAA序列与Nr4a1的3’UTR相互作用
相互作用的方式与位点:研究人员通过对 CLIP-seq 数据进行基序富集分析,发现 AAUAAA 是 Lgals3 结合位点中最丰富的元件。为验证其与 Nr4a1 的关系,设计了 Nr4a1 3′UTR 野生型和突变型质粒进行双荧光素酶报告实验,结果显示仅在 Lgals3 敲低且 Nr4a1 3′UTR 为野生型的组中,荧光素酶活性显著增加。同时,通过电泳迁移率变动分析(EMSA),使用纯化的 Lgals3 蛋白进一步证实了 Lgals3 能与 Nr4a1 的 3’UTR 区域中的 AAUAAA 序列相互作用。
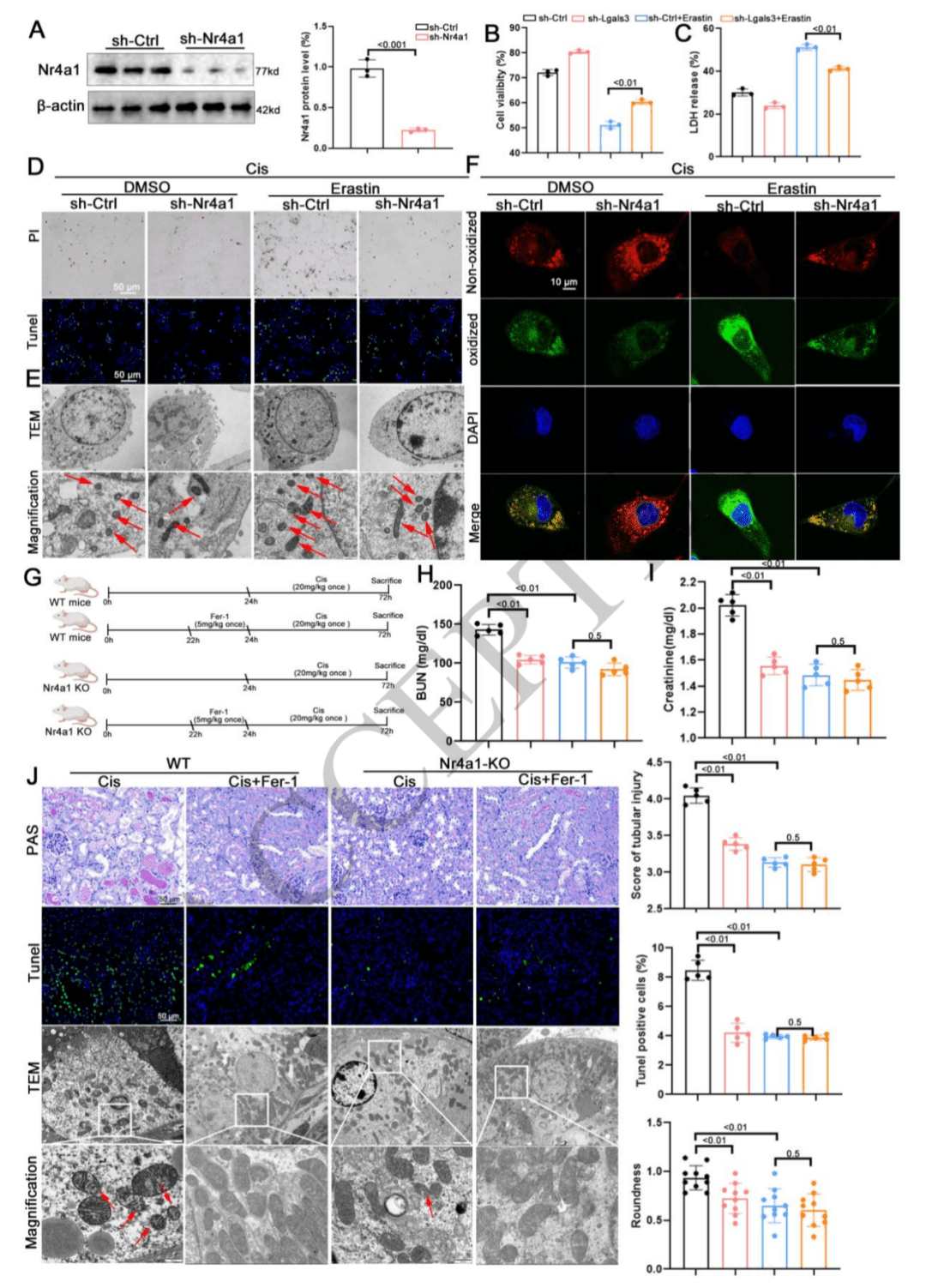
06 抑制Nr4a1在体内和体外均通过消除铁死亡来减轻肾脏损伤
体外实验:在 HK-2 细胞中敲低 Nr4a1,通过细胞活力检测、LDH 释放检测、TUNEL 和 PI 染色等实验,证明了抑制 Nr4a1 能减轻铁死亡激活剂 erastin 刺激下的细胞损伤。同时,透射电镜和 C11-Bodipy 染色结果表明,敲低 Nr4a1 可阻止 erastin 诱导的铁死亡激活,表明在体外抑制 Nr4a1 同样能减轻肾脏细胞损伤。
作用机制:体内外实验均表明,抑制 Nr4a1 减轻肾脏损伤主要是通过消除铁死亡来实现的,这揭示了 Nr4a1 在调节肾脏损伤与铁死亡之间的关键联系。
07 靶向 Nr4a1 的3’UTR的反义寡核苷酸(ASO)可减轻急性肾损伤中的铁死亡
干预方式:开发了靶向 Nr4a1 的 3’UTR 区域中 AAUAAA 序列的 ASO,旨在通过干扰 Lgals3 与 Nr4a1 的相互作用来影响相关生物学过程。
缓解铁死亡:在体内外实验中,给小鼠注射该 ASO 或在细胞实验中使用该 ASO 处理后,结果显示其能有效抑制顺铂诱导的铁死亡。通过 TEM 观察到线粒体损伤减轻,Western blot 分析发现铁死亡相关蛋白(如 Slc7a11 和 GPX4)的表达水平改变,C11-Bodipy 581/591 染色表明脂质 ROS 生成减少,这些都证明了 ASO 对铁死亡的缓解作用。
减轻肾脏损伤:从肾脏功能和组织学分析来看,注射 ASO 的小鼠肾脏功能得到改善,肾脏组织的病理变化减轻,表明 ASO 在缓解铁死亡的同时,也减轻了 AKI 导致的肾脏损伤。
08 Nr4a1 通过与 Bap1 的启动子结合来调节铁死亡
关键调控关系:确定了 Nr4a1 通过直接结合 Bap1 的启动子区域,实现对 Bap1 转录的调控,进而影响铁死亡过程。这表明 Nr4a1 在调控铁死亡中并非独立发挥作用,而是与 Bap1 存在紧密的上下游调控联系。
对铁死亡的影响:在 AKI 的背景下,Nr4a1 对 Bap1 的调控最终导致铁死亡的激活或抑制。当 Nr4a1 结合到 Bap1 启动子促进其转录时,会促使细胞发生铁死亡;敲除或抑制 Nr4a1,则会减少 Bap1 表达,从而抑制铁死亡,减轻肾脏损伤。这一机制明确了 Nr4a1 在 AKI 相关铁死亡中的关键推动作用。
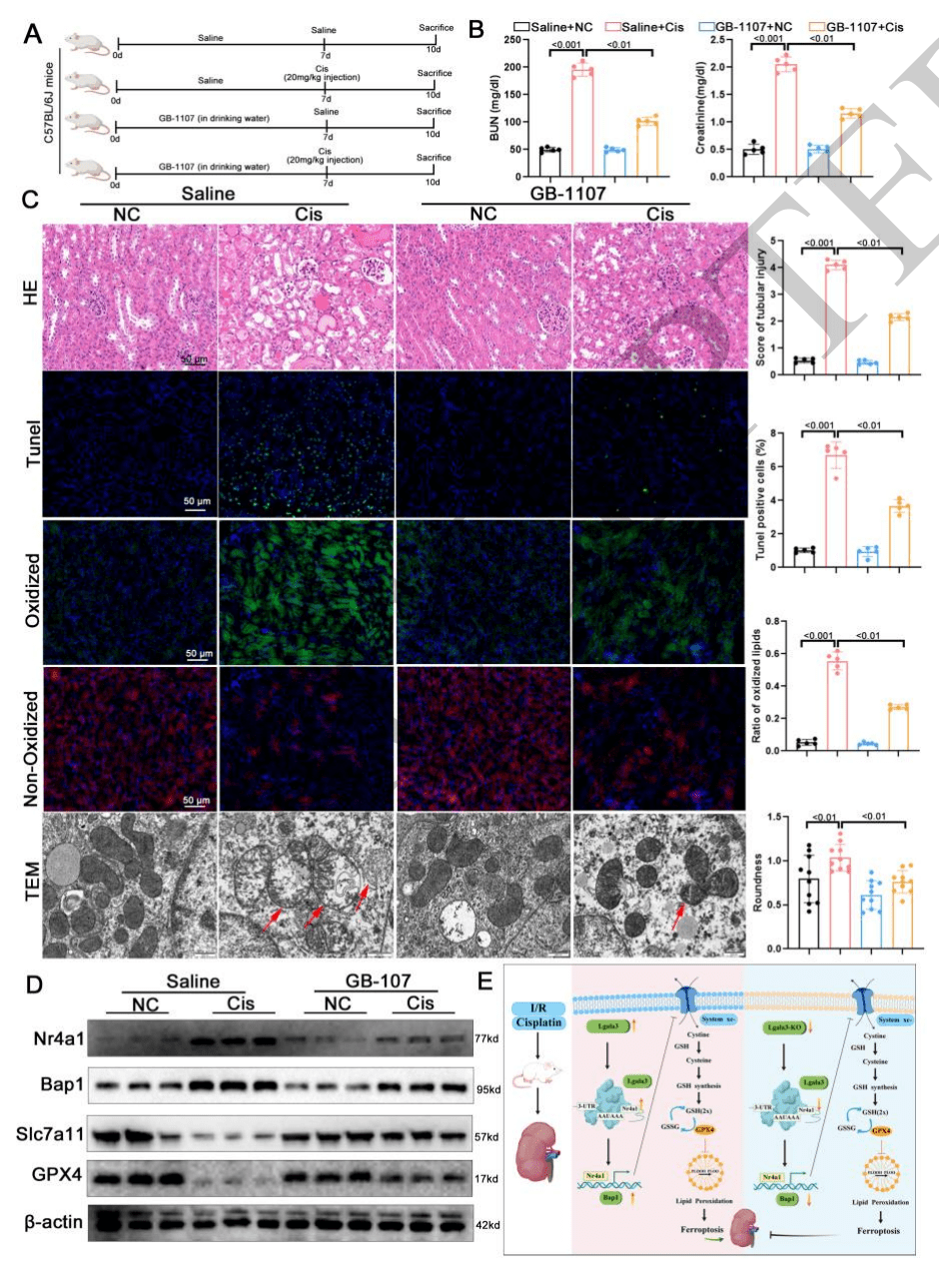
09 药理学抑制Lgals3可减轻铁死亡并减轻肾脏损伤
对铁死亡的影响:经 GB1107 处理后,通过检测关键指标发现,其能显著缓解铁死亡现象。例如,C11-Bodipy 染色和透射电镜(TEM)结果显示,脂质过氧化水平降低,线粒体损伤减轻,这表明铁死亡进程得到有效抑制。
对肾脏损伤的作用:在评估肾脏功能方面,GB1107 处理组小鼠的肾功能指标(如血尿素氮 BUN 和肌酐)明显改善;肾脏组织的病理染色(如 HE、TUNEL 染色)结果表明,肾脏损伤程度减轻。此外,蛋白质免疫印迹分析显示,GB1107 能有效抑制 Nr4a1 和 Bap1 的表达,进一步说明其减轻肾脏损伤的效果。