单细胞测序让我们看清了肿瘤的“细胞组成”,却丢失了关键的“位置信息”。空间转录组技术如同一张超高精度的“分子地图”,揭示了细胞在原生微环境中的行为与互动。如何将这一强大工具转化为具体的研究思路?本文结合近期顶刊案例,为您梳理出四大核心方向。
思路一:空间结构鉴定
发现肿瘤中的“功能特区”
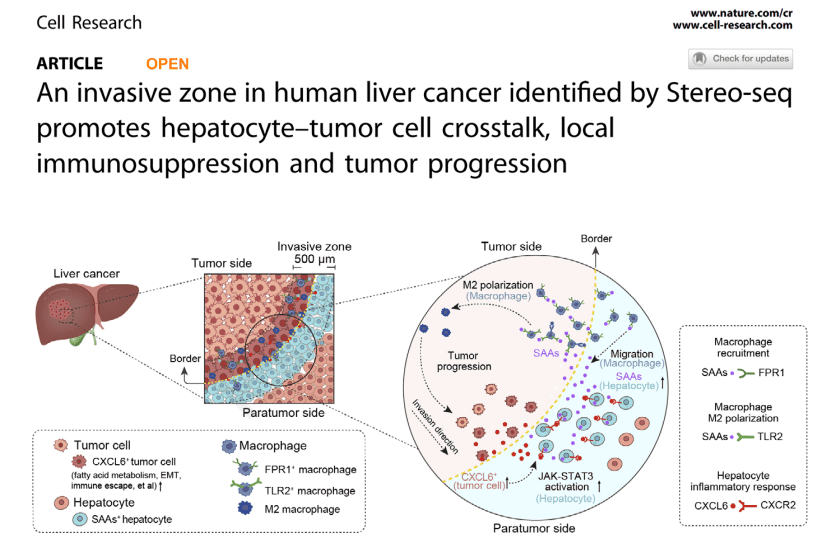
发现:研究者利用Stereo-seq的高分辨率,在肝癌组织边界精准定义了一个宽约500μm的“侵袭前沿区”。该区域是肿瘤细胞与正常肝细胞、免疫细胞(特别是巨噬细胞)交流最活跃的“战略枢纽”,是免疫抑制和肿瘤进展的关键区域。
思路价值:将研究焦点从“整个肿瘤”缩小到“关键边界”,为干预肿瘤侵袭提供了精准的时空靶点。
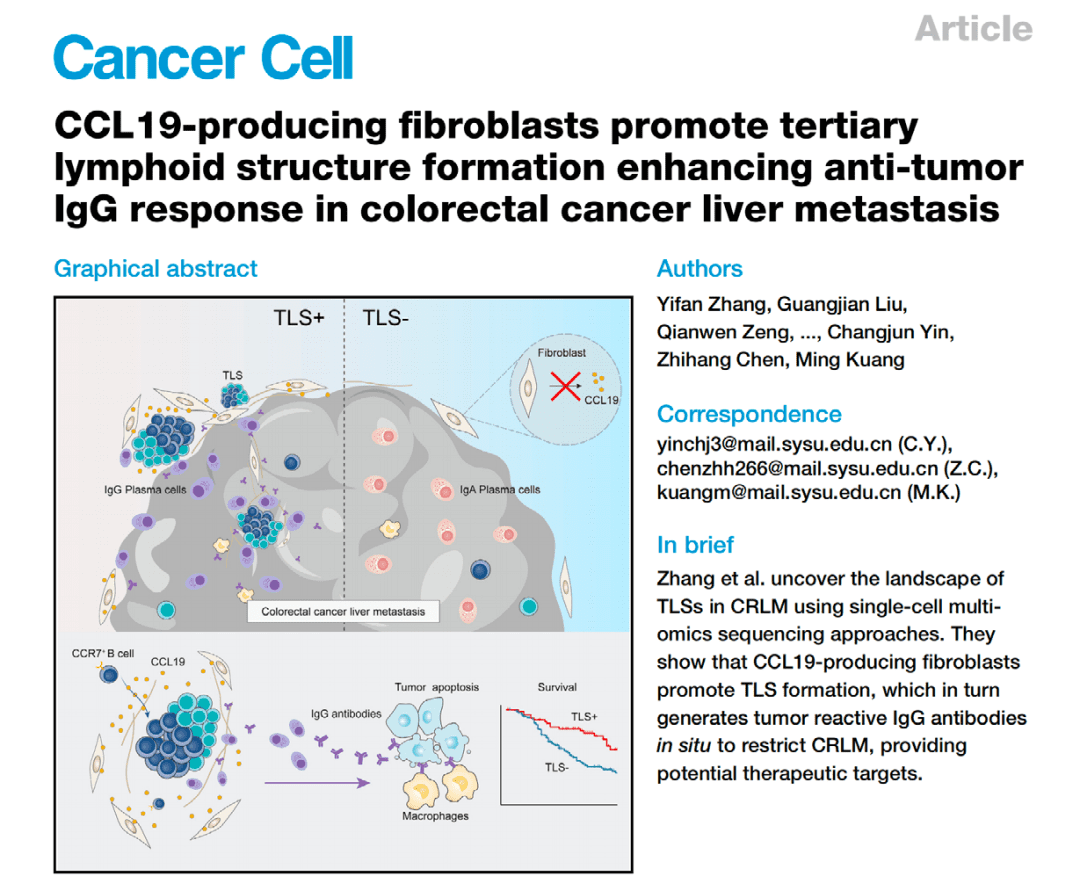
发现:在结直肠癌肝转移灶中,研究发现产生CCL19的成纤维细胞会促进三级淋巴结构的形成。空间数据显示,TLS是局部产生抗肿瘤IgG抗体的“兵工厂”,与更好的预后相关。
思路价值:将一种微观结构(TLS)的“位置”与其“功能”(产生抗肿瘤抗体)直接关联。,证明了“位置决定功能”。
• 肿瘤核心、边界、远隔正常区域的基因表达谱有何系统性差异?
• 这些空间区域与临床病理特征(如分期、分级、预后)有何关联?
思路二:细胞互作解码
绘制肿瘤微环境中的“细胞社交网络”
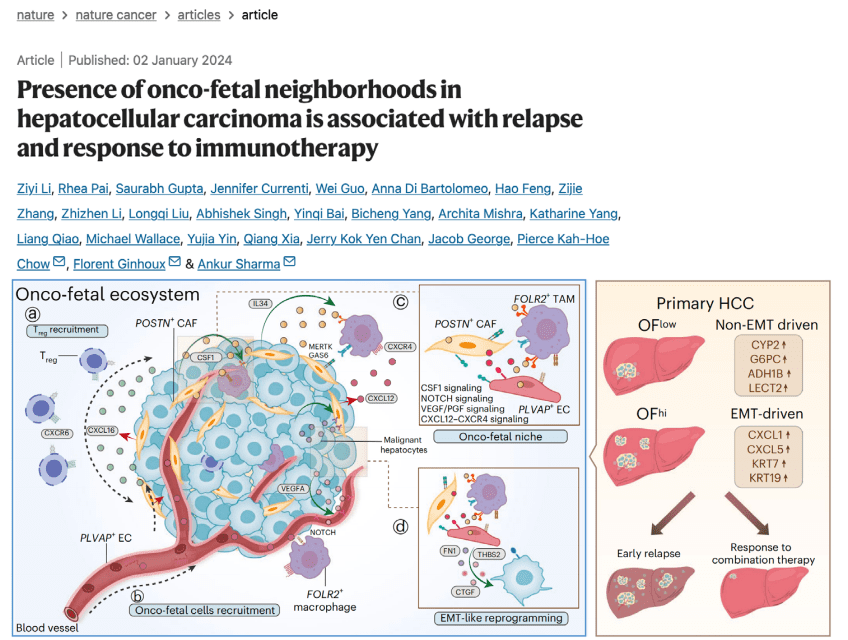
发现:研究者发现POSTN+癌症相关成纤维细胞、FOLR2+巨噬细胞和PLVAP+内皮细胞这三群细胞在空间上形成共定位的“癌-胚邻域”。这种类似于胎儿发育时期的细胞联盟,与肿瘤复发和免疫治疗耐药密切相关。
思路价值:超越了“一对一”的细胞互作,揭示了“多细胞联盟”在驱动肿瘤恶性演进中的核心作用。
发现:通过多组学整合,研究者定义了肿瘤细胞不同的“元程序”状态,并发现MP6/7状态的肿瘤细胞与周围的免疫细胞形成了独特的双向通讯网络,从而影响了免疫治疗的响应。
思路价值:将肿瘤细胞的异质性与免疫微环境的特征在空间上联系起来,为寻找预测性生物标志物提供了新范式。
• 导致耐药的关键细胞“对话”是由哪两种(或多种)细胞通过什么信号通路介导的?
• 在转移灶中,癌细胞如何“教育”远端器官的基质细胞,为自己创造“生态位”?
思路三:动态过程追踪
揭示治疗响应与肿瘤演化的“时空电影”
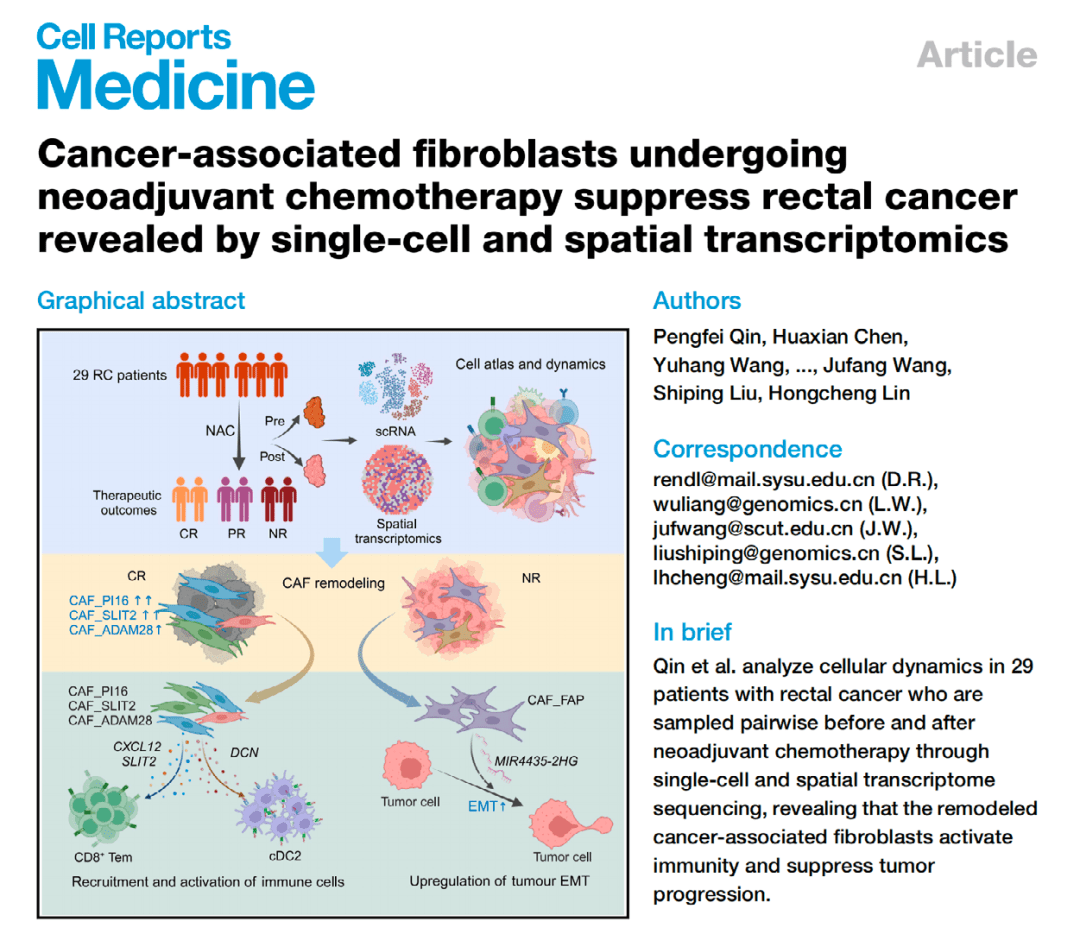
发现:通过对比新辅助化疗前后的直肠癌样本,研究发现化疗显著改变了癌症相关成纤维细胞的亚群比例。其中CAF_PI16等亚群在疗效好的患者中增加,而CAF_FAP亚群则通过诱导EMT导致耐药和预后差。
思路价值:直观揭示了治疗如何“重塑”肿瘤微环境,并识别出导致治疗成功或失败的关键细胞玩家。
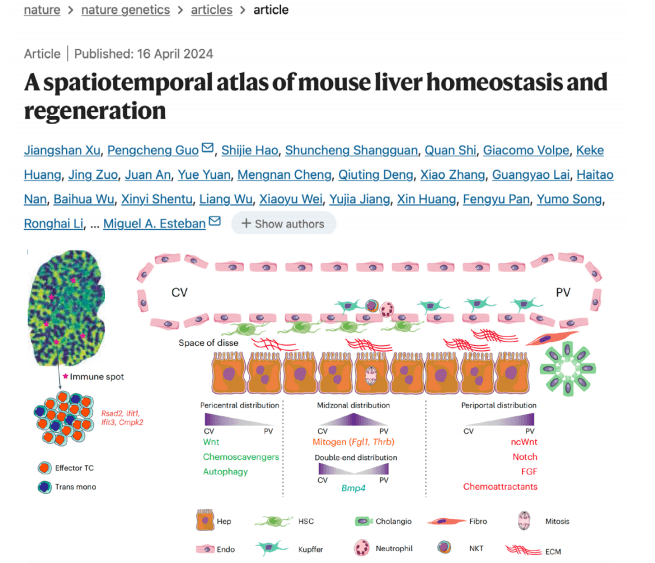
发现:构建了小鼠肝脏从稳态到切除后再生的完整时空图谱,揭示了不同肝叶中基因表达的梯度变化以及细胞通讯网络的动态演变,并识别出关键调控因子TBL1XR1。
思路价值:再生与癌变共享许多信号通路。理解正常组织修复的空间调控,能为理解肿瘤的异常增殖提供关键线索。
• 肿瘤复发时,其空间微环境结构与初发时有何本质区别?
• 利用多个时间点的空间数据,推断肿瘤细胞的“空间进化”路径。
思路四:生物标志物挖掘
从“空间位置”中寻找预后与预测指标
● 细胞邻域:特定细胞类型在空间中是否形成稳定的“联盟”?
● 空间熵:细胞类型的分布是井然有序还是混乱无序?
● 最近邻距离:关键细胞(如杀伤性T细胞)与癌细胞的平均距离是多少?
然后将这些量化指标与患者的临床结局(生存、复发、治疗响应)进行关联分析。
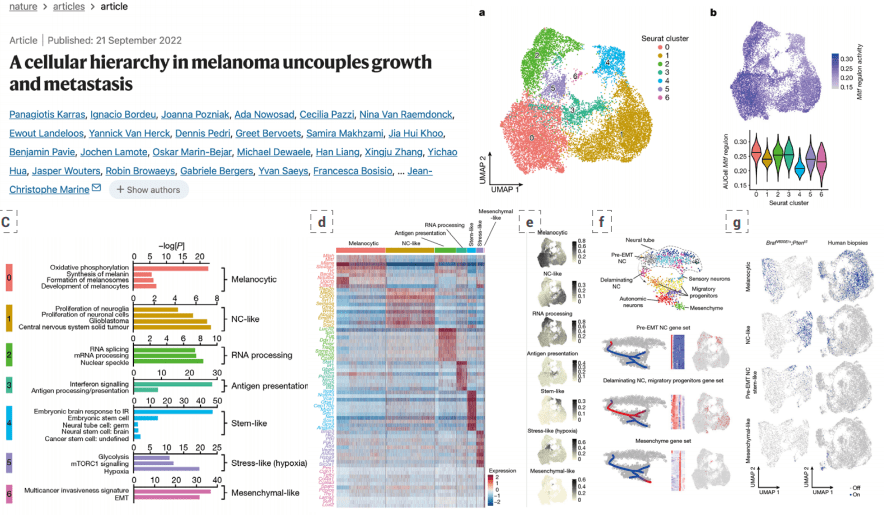
发现:这项研究不仅鉴定了驱动肿瘤生长的细胞亚群,更利用Stereo-seq的空间信息进行了一项精妙的空间量化分析。他们发现:
a. 具有pre-EMT-NC(上皮-间质转化前-神经嵴)茎样状态的细胞,与最近血管的距离呈显著负相关。这意味着这些最具转移潜能的细胞,倾向于紧密聚集在血管周围,如同“伏兵在补给线旁”。
b. 而处于应激状态(如缺氧)的细胞,则与血管距离正相关,即被挤压到远离血管的缺氧区域。
思路价值:将“细胞状态”与“空间微结构(血管)”的相互关系,转化为一个可量化的、具有预测能力的空间生物标志物。 这提示我们,不仅仅是“有什么细胞”,更是“这种细胞在什么位置”,决定了其最终的临床结局。评估pre-EMT-NC细胞与血管的平均距离,可能成为预测黑色素瘤转移风险的全新指标。
○ 密度:单位面积内TLS的数量。
○ 成熟度:内部是否形成了明显的生发中心。
○ 位置:位于肿瘤核心还是侵袭前沿。
发现:高密度、高成熟度的TLS与更好的免疫治疗响应和患者生存期显著相关。这是传统免疫组化(只能看CD8+ T细胞密度)难以精确评估的。
思路价值:证明了基于“空间结构特征”的生物标志物,比单纯的细胞浸润比例更具预测力,是跨癌种的通用型标志物。
• 能否量化“免疫细胞杀伤前线”?即,计算细胞毒性T细胞穿透到肿瘤巢最深处的距离,这可能比整体的T细胞浸润比例更具预测价值。
• 利用人工智能分析整个空间转录组切片,直接挖掘出与临床结局最相关的“空间结构模式”本身作为标志物。
它正迅速从“前沿技术”变为“常规武器”
将帮助你在激烈的科研竞争中,找到那片属于你的、充满发现的“新大陆”~
抓住技术红利期,立即联系我们,不止于测序
更是助力深度数据挖掘和科学问题的解决
以更低成本、更高效率,实现更高水平的突破!
