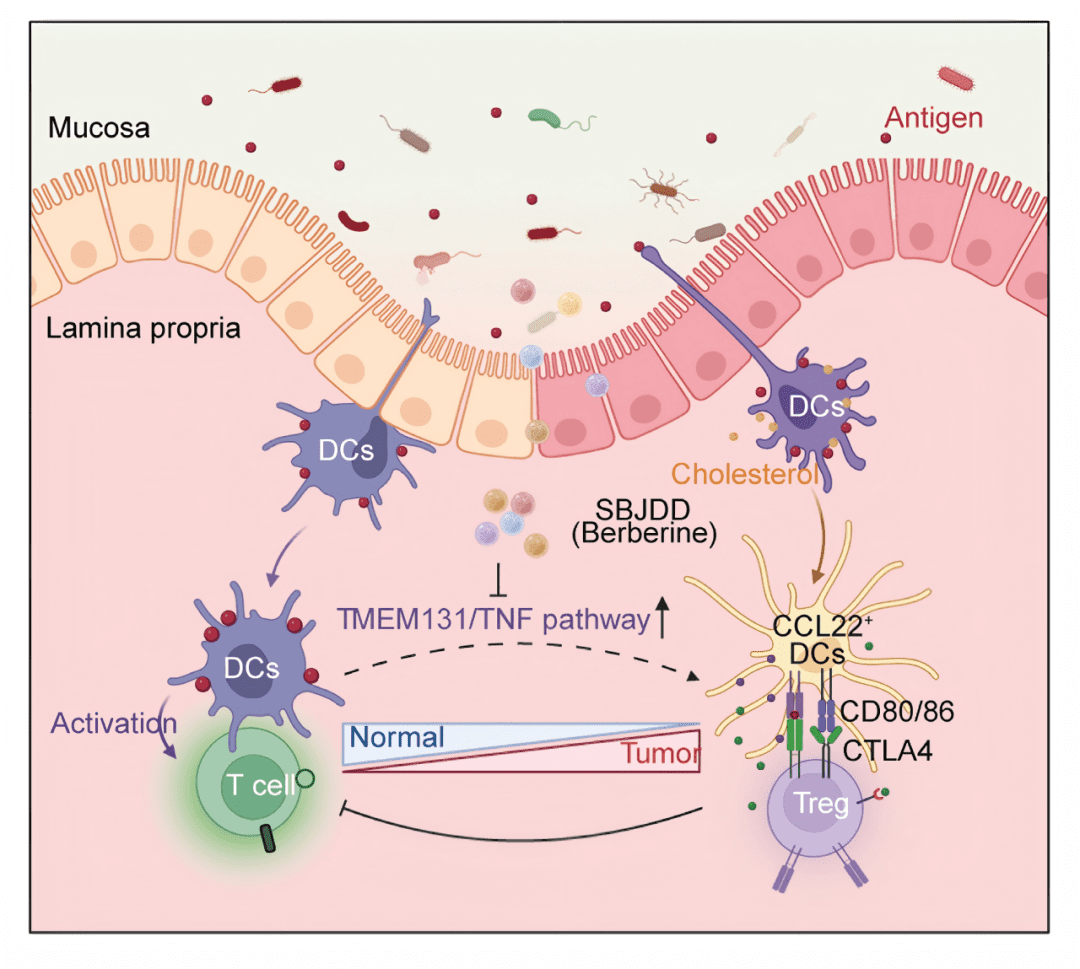
参白解毒汤(SBJDD)通过靶向CCL22⁺树突细胞(DCs)的TMEM131-TNF通路,逆转免疫抑制性TME,阻断结直肠癌变!
“当单细胞测序‘遇见’中医药,千年古方正在解码为精准抗癌新武器。想探索单细胞测序如何为您的课题赋能?欢迎联系我们!
原文速览

中文标题:单细胞 RNA 测序揭示参白解毒汤通过调节 TMEM131-TNF 信号通路介导的免疫抑制性树突状细胞分化来延缓结直肠肿瘤发生
期刊:Acta Pharmaceutica Sinica B (Q1 IF 14.6)
发表时间:2025.7
DOI: 10.1016/j.apsb.2025.05.01
技术路线
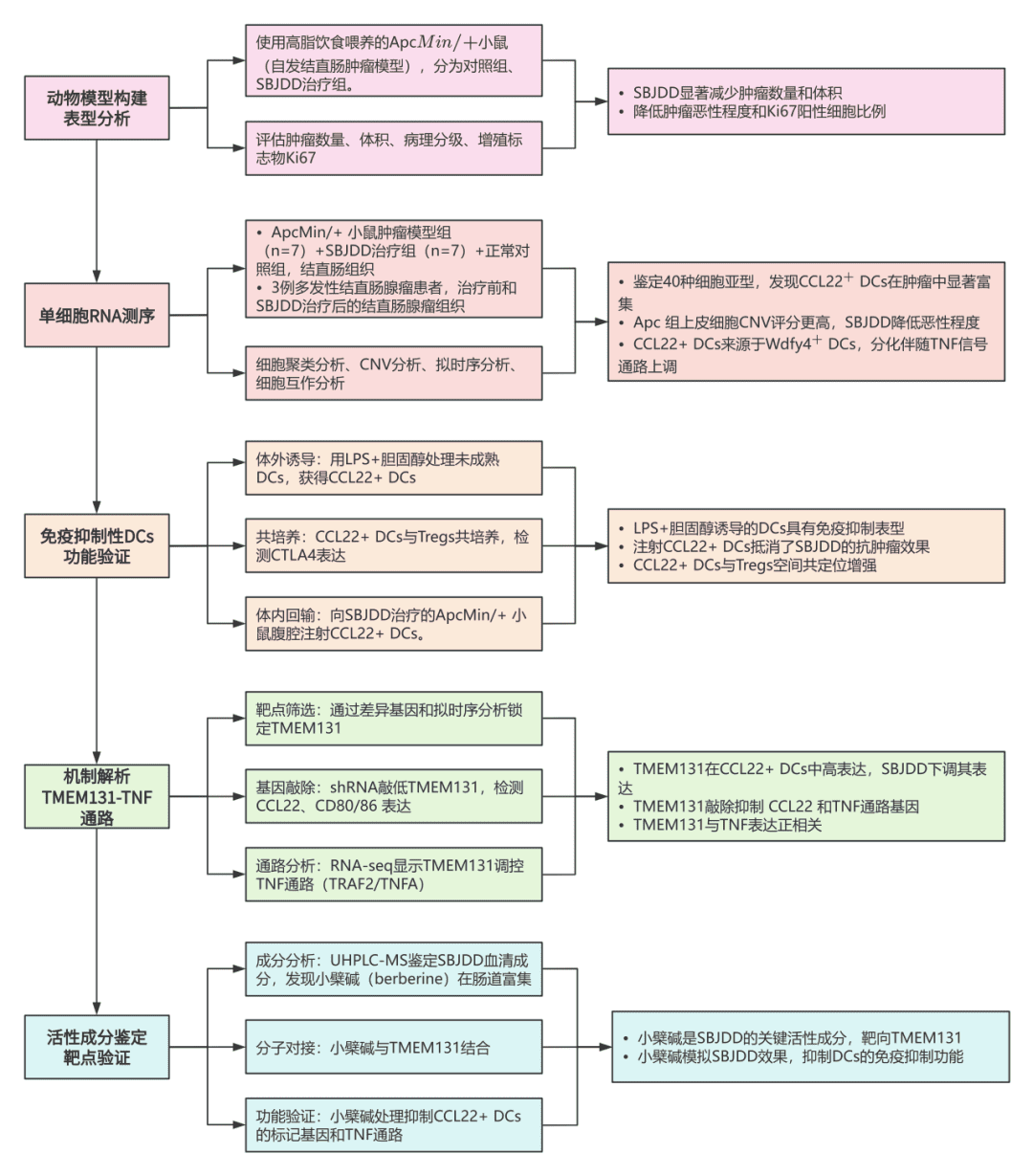
为什么选择单细胞测序?
(2)揭示结直肠癌变过程中TME的关键变化:
▪ 免疫抑制性细胞(如CCL22⁺ DCs、Tregs、SPP1⁺ TAMs)显著富集(参考原文Fig.2A);
▪ 恶性上皮细胞拷贝数变异(CNV)评分升高(参考原文Fig.1J-K),而参柏解毒汤(SBJDD)治疗可逆转这一现象。
▪ 特征基因:高表达 Ccl22, Ccl17, Ccr7, Fscn1Ccl22, Ccl17, Ccr7, Fscn1(参考原文Fig.S2C-D);
▪ 在癌变组织中显著富集(AUCell评分验证,参考原文Fig.2B);
▪ 空间定位:与CD4⁺FOXP3⁺ Tregs距离缩短,形成免疫抑制微环境(参考原文Fig.3C)。
(2)功能演化:分化过程中伴随:
▪ 抗原呈递功能下调:MHC II类分子相关通路(如抗原加工呈递)显著抑制(参考原文Fig.2I);
▪ 促癌功能上调:TNF信号通路、激酶激活活性等通路激活(参考原文Fig.2I, S3D)。
▪ CCL22⁺DCs比例显著降低(参考原文Fig.2A, 4E);
▪ DC分化轨迹改变:DC_2(人源CCL22⁺ DCs类似亚群)比例减少,且其分化停滞状态被逆转(参考原文Fig.4F);
▪ 关键靶基因:发现跨膜蛋白 TMEM131 在CCL22⁺ DCs分化中上调(参考原文Fig.6C),且受SBJDD抑制。
▪ SBJDD治疗降低腺瘤中DC_2亚群(人源CCL22⁺ DCs)比例(参考原文Fig.4E);
▪ DC_2与小鼠CCL22⁺ DCs具有相似分子特征(参考原文Fig.4G),支持机制保守性。
与传统中医药研究相比的优势
Tao Y, Ma Y, Gu L, et al. Single-cell RNA sequencing reveals Shen-Bai-Jie-Du decoction retards colorectal tumorigenesis by regulating the TMEM131-TNF signaling pathway-mediated differentiation of immunosuppressive dendritic cells. Acta Pharm Sin B. 2025;15(7):3545-3560. doi:10.1016/j.apsb.2025.05.013

