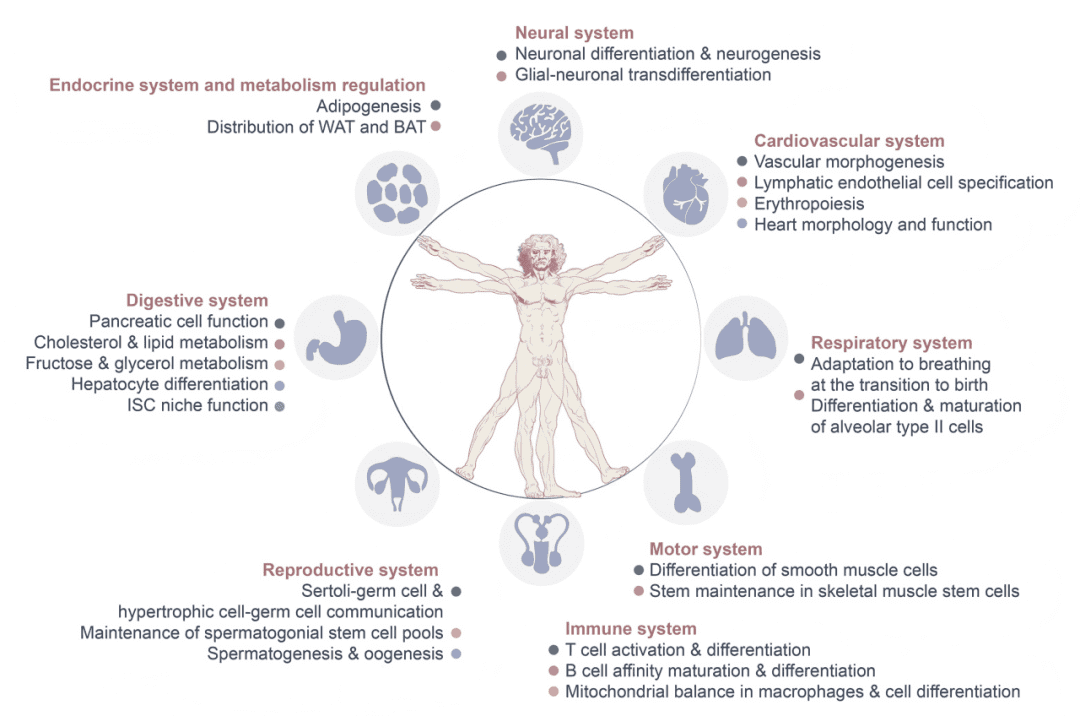
生殖系统
随着基因修饰小鼠的应用,参与精子发生的新的AS相关RBPs不断被发现,包括SAM68、PTBP2和RBM5。
值得注意的是,PTBP2控制涉及细胞粘附和极性的功能网络,对塞托利细胞-生殖细胞通讯至关重要。PTBP2直接结合AS靶标来抑制多个基因的ASE,并控制有丝分裂和减数分裂生殖细胞之间发生的ASE。 PTBP2 还通过稳定塞托利细胞中的肌动蛋白细胞骨架来调节生殖细胞和肥大细胞之间的通讯网络。
此外,HNRNPH1 在减数分裂细胞中高表达,对 ASE 调控精子发生至关重要。当 HNRNPH1 在男性生殖细胞中被敲除时,ASE 的异常会影响减数分裂以及生殖细胞和肥大细胞之间的通讯,最终导致男性不育。HNRNPH1 直接结合 SPO11 mRNA,并募集 PTBP2 和 SRSF3 协同调控靶基因的 AS。SPO11 基因编码两种主要的亚型(SPO11α 和 β),它们的区别在于外显子 2 的跳跃(α)或包含(β)。减数分裂早期的精母细胞主要产生 SPO11β,而 SPO11α 的功能在减数分裂晚期至关重要。有趣的是,HNRNPH1 也是卵子发生所必需的。在胚胎雌性生殖细胞中缺失 HNRNPH1 会导致女性不育,并导致减数分裂和细胞间连接缺陷。
近期小鼠精子发生研究表明,AS 的重要组成部分 Bud31 对精原干细胞库的维持和精子发生的启动至关重要。基因敲除导致 Cdk2 的内含子 1 保留,导致其表达降低,从而导致精原细胞丢失和男性不育。
SRSF 家族成员也参与精子发生的调控。缺乏 SRSF10 时,精原干细胞的分化和减数分裂启动会失败。 SRSF10 的缺失会干扰与生殖细胞发育、细胞周期和染色体分离相关的基因中的 ASE,包括 Nasp、Bclaf1、Rif1、Dazl、Kit、Ret 和 Sycp1。
除了前面提到的 RBPs 之外,RBM5、BCAS2、NANOS2 和 DDX5 也已被确定为精子发生过程中不可或缺的 SFs。这些蛋白质调控mRNA的ASE,而后者对于精子的产生至关重要。
神经系统
在神经祖细胞 (NPC) 中,PTBP1 抑制 PTBP2 的外显子 10 插入,导致外显子跳跃和带有提前终止密码子 (PTC) 的转录本,以及神经母细胞瘤 (NMD)。随着 NPC 逐渐分化为神经元,PTBP1 下调,而 SRRM4(作为 PTBP2 中 ASE 的正调控因子)上调。
PTBP2 在 NPC 中表达,负责抑制编码控制细胞命运、增殖和肌动蛋白细胞骨架的蛋白质基因中成体特异性替代外显子。这有助于组织发育过程中的神经元发育和组织维持。
RBFOX1 是另一个在神经发育过程中调节 ASE 的关键 AS 相关 RBP,它介导 RBFOX1 前 mRNA 外显子 19 的 AS,产生核内(外显子 19 除外)或胞质内(外显子 19 包括在内)蛋白质异构体。在RBFOX1基因敲除的神经元中,超过500个异常的盒式外显子ASE出现在mRNA前体上,导致外显子插入或跳跃发生显著改变。进一步研究发现,PTBP1和RBFOX1在ASE中起拮抗作用。在NPC中,PTBP1促进细丝蛋白A转录本中毒性外显子(外显子-N)的跳跃,以维持NPC的分层。外显子-N的插入会引入PTC,导致蛋白质截短和/或NMD。此外,神经肽(Ninein)是一种重要的蛋白质,在神经干细胞中调控神经元轴突的发育和着丝粒结构的形成,它会转化其前mRNA。神经肽的18号外显子在QKI-5的调控下被排除,而29a号外显子在RBFOX的介导下被纳入,导致其着丝粒非神经元异构体转化为与微管相关的非着丝粒神经元异构体。这诱导神经母细胞瘤(NPC)分化为神经元细胞。
此外,其他RBP也参与神经分化。神经肿瘤腹侧抗原2(NOVA2)控制失活同源物1(DAB1)中7b和7c号外显子的排除,参与哺乳动物大脑皮层发育过程中的微管信号传递。RBFOX3通过与上游内含子UGCAUG元件结合,促进信号衔接蛋白numb中另一种外显子跳跃。当RBFOX3在发育中的鸡脊髓中表达受到抑制时,NUMB的这个外显子会被包含进去,从而阻碍神经元分化。
HuD和SAM68在神经发育的不同阶段发挥着不可或缺的作用,这表明在神经发育的不同阶段,特定的调控伙伴关系受到调控。这些研究为RBPs如何通过AS影响神经发育提供了新的见解。
最近,胶质细胞-神经元转分化领域围绕PTBP1展开了激烈的争论。Qian等人指出,星形胶质细胞中PTBP1的下调可以刺激新的功能性多巴胺神经元的产生,促进受损神经回路的重建,并恢复帕金森病小鼠模型中纹状体的多巴胺水平。然而,后续研究反驳了这一观点,声称 PTBP1 的敲除或下调不会诱导神经胶质细胞分化为神经元。
消化系统
小鼠体内 RBM4 的缺失会引发代谢变化以及胰腺细胞分化和功能所需的 ASE 错误。具体而言,RBM4 可以调节转录因子 ISL1 和 PAX4 的 ASE,从而调节胰岛素基因的表达。这凸显了 RBPs 在维持胰腺细胞功能和整体代谢健康方面的复杂作用。
多项研究已经阐明了不同 SFs 在健康和疾病状态下调节肝脏发育、稳态和代谢的分子机制。随着小鼠肝脏的生长,IGF2BP1 的表达逐渐减少,导致 RNA poly(A) 尾缩短,胎儿肝脏 RNA 稳定性降低。此外,IGF2BP1 与胰岛素样生长因子 2 mRNA 结合,阻止其与赖氨酸脱甲基酶 5B (KDM5B) mRNA 结合,从而降低 KDM5B mRNA 的稳定性。同时,促进 RNA 降解的 RBPs(例如 CSDE1 和 KSRP)逐渐增加。这表明 AS 相关的 RBPs 在肝脏发育过程中具有动态调控作用。
肝脏是胆固醇平衡和脂质代谢调节的主要部位,与脂蛋白的合成密切相关。脂蛋白在脂质代谢中至关重要,并部分受 AS 相关的 RBPs 控制。例如,RBFOX2 调节一系列参与维持脂质平衡的 ASEs。这些事件包括与B类清道夫受体I型(Scarb1)、磷脂酶A2第VI组(Pla2g6)、NUMB网格蛋白囊泡适配器(Sec31a COPII囊泡转运系统的组成部分)和氧固醇结合蛋白9(Osbpl9)相关的事件。此外,肝细胞特异性RBFOX2基因敲除导致血液胆固醇水平降低,肝脏胆固醇、胆汁酸和其他脂质水平升高,表明RBFOX2在控制脂质分布中起关键作用,可能成为治疗目的的靶点。
Vatandaslar等人利用viP-CLIP识别小鼠肝脏中的RBP靶点,发现TIAL1可以靶向Insig2和ApoB来调节它们的ASE,从而控制胆固醇的合成和分泌。
SRSF家族成员在肝脏中的生理调节作用已被广泛研究。例如,SRSF1 调节肝细胞脂质代谢和运输。在 SRSF1 靶向缺陷的小鼠中,急性肝损伤与有害 RNA-DNA 杂合体(R 环)的过度形成有关,这会诱导 DNA 损伤,并进一步导致肝细胞基因组学改变、代谢紊乱和急性肝损伤。此外,SRSF3 是肝细胞分化所必需的,SRSF10 参与调节脂肪形成和肥胖,SLU7 是肝脏稳态所必需的。
最近的研究表明,出生后肝脏的重塑和成熟是由细胞类型特异性转录和转录后调控的协同变化驱动的。在肝脏中,ESRP2 是少数在出生后诱导的 RBPs 之一。 ESRP2 调控肝细胞内一系列保守的 AS 转化,从而控制终末分化和成熟。ESRP2 的下调会激活新生 ASE,削弱 Hippo 信号转导,并增强下游靶基因的转录。这一过程促进肝组织再生。然而,过量饮酒会释放炎症细胞因子,显著抑制这一过程,导致酒精性肝炎。
果糖和甘油是肝脏营养代谢的重要组成部分。酮己糖激酶 (Khk) 是果糖分解的限速酶,它将果糖代谢为 1-磷酸果糖。同时,甘油激酶 (GK) 在碳水化合物和脂质代谢的界面上起作用,催化甘油转化为 3-磷酸甘油。大量研究表明,AS 相关的 RBPs 参与调节 KhK 和 GK 的 ASE。外显子 3a 和 3c 发生互斥剪接,产生两种亚型:KHK-C 和 KHK-A。SF3B1 可以调控 AS 模式,从低活性的 KHK-A 到高活性的 KHK-C,其中 KHK-A 的生成需要 HNRNPH1/2 的参与。另一个 HNRNP 家族成员,APOBEC1 补充因子 (A1CF),含有三个不同的 RRM,是载脂蛋白 B mRNA 编辑的重要组成部分。A1CF 作为一种肝细胞特异性 AS 相关 RBP,通过控制 ASE 来调节肝脏富集亚型的产生。其中最重要的 ASE 是调节 KHK-C 亚型的产生,这一过程与 HNRNPH1/2 是拮抗的。此外,肝细胞中的 A1CF 调节外显子 5 在 GK 中的停留,从而促进甘油刺激的葡萄糖生成。
综上所述,AS 在消化系统发育中的作用主要体现在调节特定基因的表达和功能,影响肝脏的代谢过程和生理状态。这些研究结果为我们理解某些疾病的发生机制和寻找新的治疗策略提供了重要线索。未来的研究可以侧重于阐明特定 AS 网络(包括 AS 相关的 RBPs 及其下游同工酶)在响应不同代谢需求方面的作用。
免疫系统
CD45是T细胞分化和活化过程中的关键细胞表面分子,是HNRNPL的靶标之一,并参与HNRNPL依赖的ASE,导致T细胞活化后外显子4跳跃。
PTBP1的缺失会破坏T细胞稳态,但不影响T细胞发育;PTBP1的缺失会增强树突状细胞(DC)的功能。在PTBP1敲除的DC中,鉴定出33种不同的ASE,其中包括PKM的ASE和部分IFN应答基因受PTBP1调控。缺乏PTBP1的树突状细胞(DC)表现出更强的抗肿瘤作用,进一步表明PTBP1可能是一个潜在的治疗靶点。
最近的一项研究强调,AS在双阳性胸腺细胞向单阳性胸腺细胞的转变中起着至关重要的作用。这主要涉及前体转录因子Foxa1和Foxa2,它们调节MBNL1、H1F0、SF3B1、HNRNPA1、RNPC3、PRPF4B、PRPF40B和SNRPD3的表达。在接受正向选择的CD69+DP细胞中,Foxa1/Foxa2的双条件性基因敲除会破坏ASE,导致出现超过850个差异表达的外显子盒。
另一项近期研究表明,SRSF1分别靶向189个和582个针对调节性T细胞和效应T细胞的AS特异基因。这些基因大多与自身免疫性疾病有关,进一步证实了SRSF1在保护健康细胞和组织免受免疫系统攻击方面的重要作用。
已证实B细胞中PTBP1的上调对早期B细胞选择至关重要。在B细胞激活后,PTBP1对于MYC依赖性基因程序的准确表达至关重要。它直接调节在正向选择过程中逐渐增加的 ASE 和转录本丰度,从而促进细胞增殖。
HuR 与 B 细胞中 134 个 MYC 调控基因的 RNA 转录本相互作用,从而协调控制 GC B 细胞增殖和 Ig 体细胞超突变的程序。此外,HuR 调节进入和经历细胞周期 S 期所必需的 AS 和 mRNA 丰度,调节与 DNA 脱氨相关的基因特征,并保护 GC B 细胞免受 DNA 损伤和细胞死亡。在类别转换重组 (CSR) 过程中,B 细胞能够产生多种抗体,活化 B 细胞中 HuR 的耗竭会导致能量代谢失衡,导致活性氧物质的致命积累,从而损害 B 细胞增殖和 CSR 发生。
最近的研究强调 TIA1 和 TIA-like 1 (TIAL1) 是维持长期 GC 反应和产生高亲和力类别转换抗体的关键 RBP。 TIA1 和 TIAL1 配备三个 RRM,识别靶 mRNA 内含子和 3’UTR 中富含 U 的元件,主要参与 ASE 和翻译调控。在胃癌 B 细胞中,TIA1 和 TIAL1 在转录后水平调节 MCL1 的表达。MCL1 是 BCL2 家族中唯一一个对胃癌 B 细胞存活至关重要的成员。
除淋巴细胞外,近期证据也证明了 AS 相关的 RBPs 在巨噬细胞中的调控作用。小鼠巨噬细胞系的转录组分析已发现 SRSF6 是线粒体平衡的关键调节因子。SRSF6 通过与 ESE 直接相互作用来控制 BAX 内含子 1 的 AS,从而防止 BAX-κ 过度积累(这可能导致巨噬细胞死亡)。巨噬细胞检测到病原体后,会调节SRSF6的表达,以控制免疫原性线粒体DNA的释放,并调整启动程序性细胞死亡的阈值。
QKI-5在巨噬细胞分化中发挥作用。在动脉粥样硬化的进展过程中,QKI-5作为ASE及其表达谱的动态调节器,驱动单核细胞活化、粘附和分化为巨噬细胞,从而促进疾病进展。
总之,在活化免疫系统的发育过程中,RBPs至关重要,因为它们在转录和转录后过程中调节基因表达。某些RBPs(例如PTBP1)的缺失会显著破坏免疫细胞稳态,这凸显了AS相关RBPs的重要性。持续探索具有重要意义,包括它们参与免疫信号转导以及差异ASEs在遗传调控机制中对生理发育的影响。此外,了解ASEs在抗原呈递过程中的作用也至关重要。
心血管系统
NOVA2已被证实为血管内皮细胞中表达的AS相关受体结合蛋白(RBPs)的组织特异性调控因子,影响血管形态发生和淋巴管内皮细胞的特化。NOVA2直接与L1CAM前mRNA结合,导致与内皮细胞(ECs)中L1CAM跨膜结构相关的外显子跳跃。这导致可溶性L1-ΔTM的释放,其通过自分泌和旁分泌活性发挥强大的血管生成功能。此外,NOVA2还调控Ppar-γ外显子B和外显子5,以及E2F二聚化伴侣2 (Tfdp2)外显子7的插入。前者产生的亚型与血管生成和血管发育有关,而后者产生的亚型参与调节细胞凋亡、血管生成、脂肪生成和细胞迁移。NOVA2 还调控 UNC5B 跳过外显子 8,在内皮细胞中产生 UNC5B-Δ8。后者无法传导 Netrin-1 信号,并以死亡依赖性方式调节血管形成。缺乏 NOVA2 的内皮细胞表现出 MAPK/ERK 信号转导增强。 Prox1 的表达受 ERK 信号转导的动态控制,在调节淋巴细胞分化中发挥作用。
QKI-5 还通过与心肌素 (Myocardin) 结合,调节其表达和 ASE,从而激活收缩蛋白表达,从而确保血管平滑肌细胞 (VSMC) 的生理功能。 QKI-5 缺乏会导致 VSMC 生成缺陷,并导致小鼠胚胎死亡。
红细胞的生成始于造血干细胞的分化,依赖于转录和转录后程序来驱动特定阶段蛋白质组的合成。这一过程逐渐完善了细胞的功能。在红细胞生成过程中,HNRNPAB 的表达水平会下降。与此同时,RBM39 与 U2AF65 和 SF3b155 相互作用形成复合物,该复合物通过结合 TIA1 和 Pcbp1 将 U2 snRNP 募集到 BPS,从而促进 U2 snRNP 募集到分支点。这两个过程都通过 AS 促进了编码蛋白 4.1 R 的基因中外显子 16 的阶段特异性转换(包括包含和跳跃),从而调节红细胞膜稳定性。
此外,MBNL1 是协调 AS 网络内 AS 转换的调节器,在红细胞生成的顶峰发挥作用。在小鼠红细胞的终末发育过程中,MBNL1 促使 35 个核苷酸的盒型外显子被包含到核分布蛋白 nudE-like 1 (NDEL1) 中。值得注意的是,只有包含该替代外显子的 NDEL1 同工型才能部分挽救 NDEL1 缺失后观察到的分化缺陷。这些缺陷与 MBNL1 缺失时观察到的缺陷类似。
RBM38 是另一种在分化较晚的有核红细胞中诱导的 AS 相关 RBP,与翻译起始因子 eIF4G 相关,并随着 mRNA 水平的降低而促进特定 mRNA 的翻译。
AS在心脏发育中也起着至关重要的作用。CELF、MBNL1、RBM24、SRSF1、SRSF2、SRFS10和HNRNPU在正常心脏形态和功能中起着关键的调节作用。
此外,RBM20和PTBP1在选择心脏组织中的特定外显子方面表现出联合作用,RBM20在心血管疾病中的作用似乎至关重要。
最近,PTBP1在心室腔发育过程中与内皮细胞共定位的特征已被揭示。通过调节内皮细胞迁移和心肌细胞增殖,内皮特异性敲除PTBP1可导致左心室心肌致密化不全(LVNC)。在PTBP1缺陷的内皮细胞中,观察到两种ARRB1亚型的表达比例发生变化,这已被证明会影响内皮细胞的迁移。
RBM24对心肌发育至关重要。在RBM24缺失的hESC中,超过4000个错误的ASE导致肌原纤维生成停滞在肌原纤维前阶段,从而导致肌节破坏。在心脏分化的不同阶段,RBM24 促进 α-辅肌动蛋白 2 外显子 6 的插入,这对于肌节的组装和完整性至关重要。
此外,多重剪接(变体)2 型 RBP(RBPMS2)是斑马鱼和人类心肌细胞中保守的 AS 相关 RBP,参与 AS、肌原纤维组织和钙离子处理,参与心脏 AS 网络的调控。
QKI 是另一种近期被确定为心血管发育关键调控因子的 RBP,它特异性地调节 Z 线结构基因(包括 ACTN2)的 ASE。这种参与有助于心肌细胞内肌原纤维结构的形成。此外,QKI 还协调肌节细胞骨架与细胞膜之间的相互作用,突显了其在细胞结构和功能中不可或缺的作用。
总之,AS 相关的 RBP 在心血管系统的正常发育中发挥着多方面的作用。最近的一项研究强调了一种心脏特异性且保守的长链非编码RNA (lncRNA) 参与调控ASE,从而有助于维持正常的心脏功能。心血管系统中ASE的研究具有重要的研究潜力。此外,更详细地绘制心脏发育过程中ASE的谱图,可以为理解胎儿心血管系统向成人心血管系统的转变提供宝贵的见解。
运动系统
平滑肌细胞和骨骼肌干细胞受AS调控。PTBP1在此过程中起着关键作用。PTBP1抑制多个平滑肌特异性外显子。在细胞分化阶段,PTBP1表达下调会导致内含子保留增加、PTC的引入以及多聚腺苷酸化的替代使用。AS及其相关的RBPs也在间充质干细胞(MSC)的分化途径中发挥重要作用。在MSC分化为成骨细胞、脂肪细胞和软骨细胞的过程中,AS在调控MSC增殖和细胞命运决定方面起着关键作用。
HNRNPF/H调控转录因子E蛋白家族成员TCF3(E2A)的AS,而TCF3可以与调控胚胎干细胞(ESC)分化的下游基因的启动子结合。HNRNPF/H通过与PTBP1结合后再结合TCF3 ISS来调控TCF3外显子18a的保留,从而促进E12在人类ESC中的表达保留,稳定CDH1,从而维持人类ESC的多能性。在低HNRNPF/H水平下,PTBP1介导TCF3前mRNA外显子18b的保留。在高HNRNPF/H水平下,它促进TCF3外显子18a的保留。
关于成体干细胞静止调控的详细总结表明,QKI条件性缺失导致ITGA7和NUMB AS,从而抑制骨骼肌干细胞活化并减少不对称分裂。除了上述AS相关RBPs对细胞分化的调控作用外,QKI也是重要的细胞分化调控蛋白。它们影响神经干细胞、血管和肌肉的分化过程,并通过一系列机制来调控AS。
RBM24已被科学验证为肌肉特异性ASE的调控因子。它能够抵消PTBP1和HNRNPA1/A2引起的外显子插入。值得注意的是,RBM24的任何缺陷都可能导致心肌和骨骼肌的发育异常。
内分泌与代谢系统
SAM68最初被确定为酪氨酸激酶c-SRC的靶点,是STAR家族的成员,参与RNA加工,其特征是KH结构域可与U(U/A)AA基序结合。SAM68敲除小鼠的脂肪祖细胞分化减少,脂肪组织(包括白色脂肪组织(WAT)和棕色脂肪组织(BAT))的积累减少。此外,这些敲除小鼠还能预防高脂饮食引起的肥胖。全基因组外显子表达分析揭示了许多ASEs。具体而言,它会产生一种mTOR变体的截短形式,从而抑制功能性mTOR的表达并破坏mTOR信号转导,导致脂肪生成缺陷。此外,SAM68还与Rps6kb1的AS相关。SAM68敲除导致前脂肪细胞中产生新的转录异构体Rps6kb1-002,该异构体由SRSF1启动,从而抑制脂肪生成和脂质积累。
Chao等和Zhang等整合了已有的研究成果,以具体的ASEs和各种AS调控因子的不同功能为例,强调了AS机制在脂肪生成和脂肪细胞生物学中的重要作用。其中,HuR、PSPC1、Sam68、RBM4、Ybx1、Ybx2、IGF2BP2、KSRP等RBPs发挥着关键的调控作用。
近期,Peng等利用RNA直接测序技术检测了牛脂肪细胞。他们从转录本/异构体、poly(A)尾长和修饰等方面系统地分析了脂肪生成过程中转录组的变化,揭示了许多与AS相关的RNA变化。研究AS相关的RBPs在脂质代谢调控中的作用具有重要意义。其他RBPs也可能参与其他重要的代谢途径,从而进一步调控AS。准确理解这些过程在正常生理和疾病中的分子机制,有望为代谢紊乱的治疗提供新的靶点。
在内分泌系统和代谢调控中,AS及其相关的RBPs发挥着关键作用。RBPs调控一系列转录后事件,例如AS的稳定性、定位和翻译。这些过程显著影响RNA的加工和代谢,从而改变RNA的命运和功能。需要进一步研究不同类型脂肪组织中特定AS变体在肥胖发病机制中的作用机制,靶向AS相关的RBPs治疗脂质代谢紊乱具有广阔的前景。
其他系统
此外,FOX2、TIAR 和 HUB 等蛋白质有助于胎儿肺泡成熟。它们调节肺泡 II 型上皮细胞中 ErbB4 Jma 亚型的产生。在组织和器官及其生理功能的发育过程中,AS 亚型之间的变化尤为普遍。为了充分理解发育性 AS 网络的功能作用,有必要更广泛地识别与发育相关的数千种生理性 AS 变化的结构和功能。这需要将全基因组方法与跨各种系统的分子研究相结合,以彻底确定生理 AS 转换的功能影响。
Tao Y, Zhang Q, Wang H, Yang X, Mu H. Alternative splicing and related RNA binding proteins in human health and disease. Signal Transduct Target Ther. 2024;9(1):26. Published 2024 Feb 2. doi:10.1038/s41392-024-01734-2
