什么是空间代谢组学?
空间代谢组学则完美地解决了这个问题,通过一项称为“质谱成像”的应用实现的,它通过对样品进行激光扫描来逐点收集光谱,以便从空间上确定代谢物在组织中的分布。
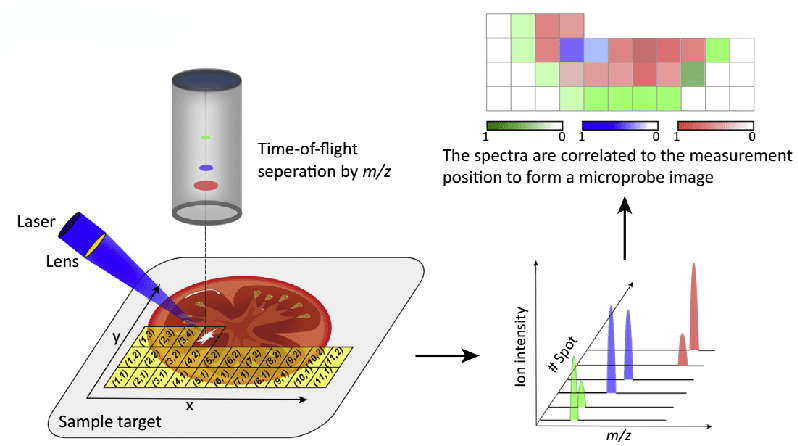
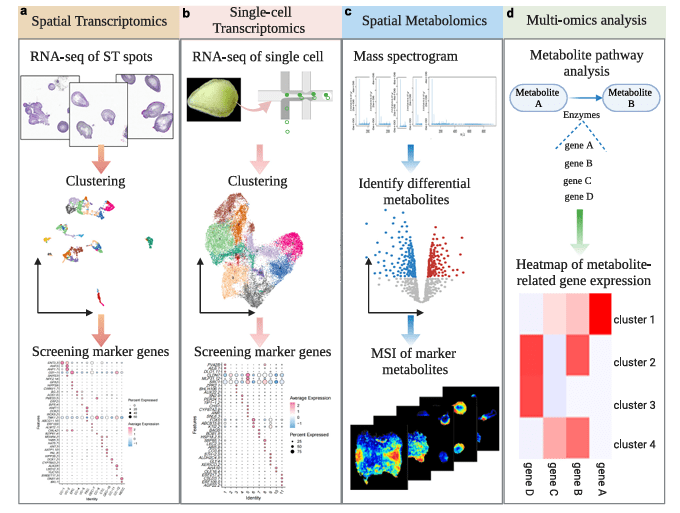
空间代谢多组学的广泛应用与前沿案例
1肿瘤生物学与精准医疗
● 指导手术边界:许多代谢物(如特定磷脂、胆碱化合物)在癌与正常组织间存在浓度陡变。MSI可绘制这些分子的分布梯度,从而在分子层面划定肿瘤边界。
● 解析耐药机制:分析药物治疗后,耐药区域和敏感区域的代谢变化,揭示耐药机制。
● 区分肿瘤亚型:根据代谢特征对看似相同的肿瘤进行精细分型,指导个性化用药。

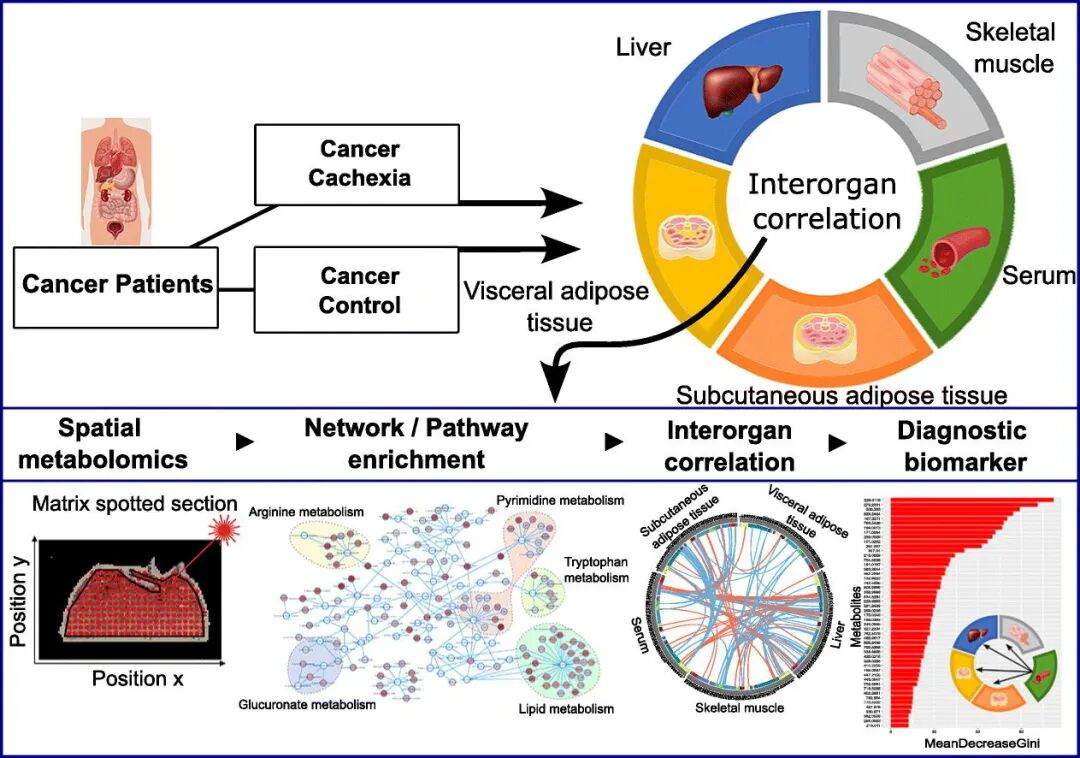
研究发现,恶病质患者在不同器官中表现出显著的代谢活性差异:脂肪组织和肝脏的代谢活动普遍增强,而肌肉组织和血清的代谢活性则下降。能量状态评估进一步揭示了组织特异性,肌肉中的能量电荷显著降低,而肝脏和脂肪组织中的能量电荷反而升高,反映了不同组织在恶病质状态下的异质性代谢适应。随着恶病质严重程度的增加,内脏脂肪组织表现出最剧烈的代谢改变,同时其脂肪细胞体积显著减小,形态学证据支持了该组织处于强烈的分解代谢状态。
研究还通过相关性网络分析揭示了器官间的代谢交互作用,其中肝脏是代谢网络的核心枢纽。碳水化合物、脂质、氨基酸和维生素代谢是跨器官互作的关键通路。最后,研究者利用机器学习成功构建了基于组织代谢谱的分类器,并能将其特征转化应用于血清样本,实现了对恶病质状态高精度的无创诊断判别,为未来开发微创诊断工具奠定了坚实基础。

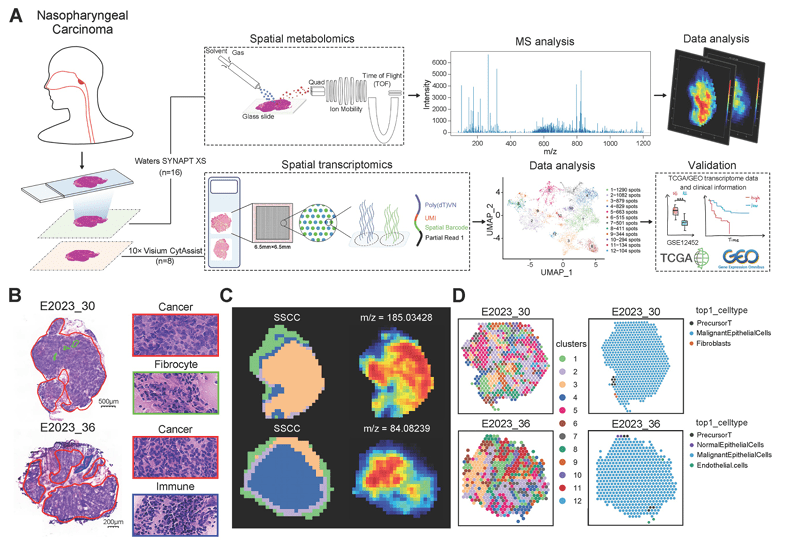

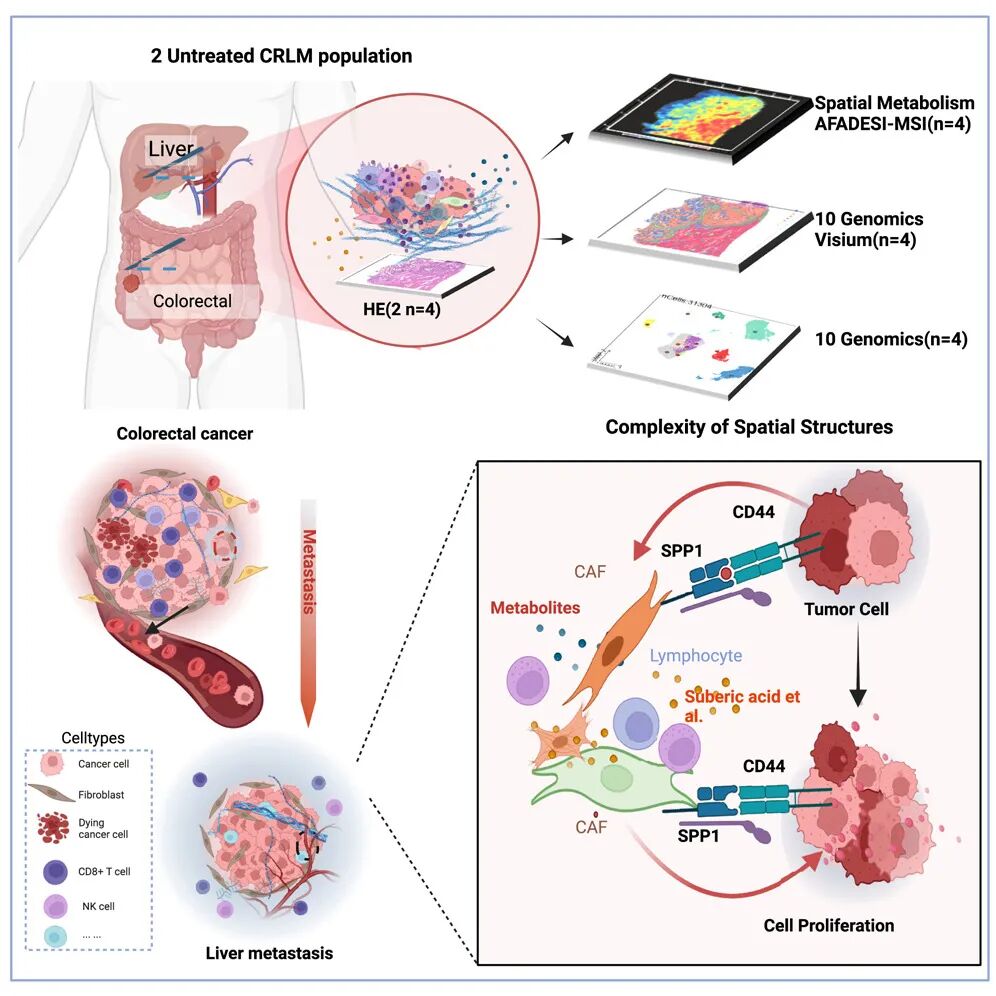
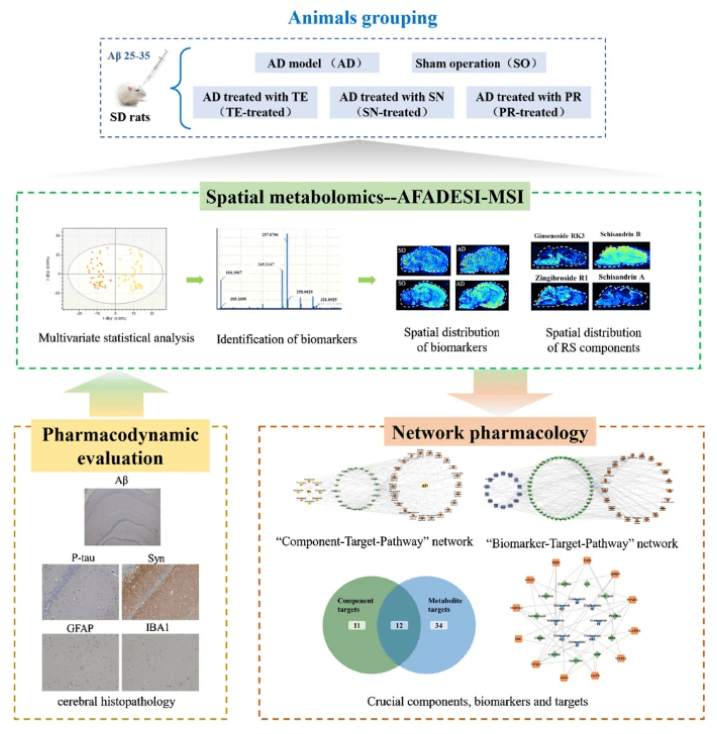
2神经科学与脑疾病研究
● 揭示疾病机制:将MSI技术与免疫组化染色结合,直接分析病理蛋白沉积斑块(如Aβ斑块、α-突触核蛋白聚集物)周围的代谢微环境。
● 追踪药物分布:直接观察药物及其代谢产物能否穿越血脑屏障,并在大脑的哪个部位富集。

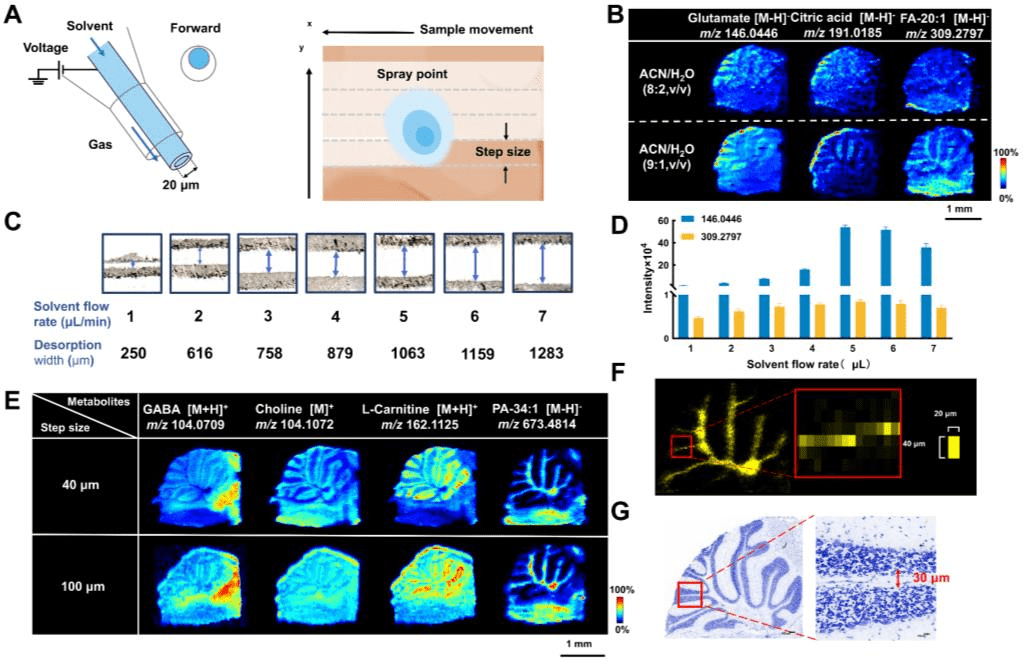
3植物科学与中药材研究
● 研究抗逆机制:观察植物在遭受病虫害、干旱、盐胁迫时,防御性代谢物在叶片或根部的原位合成与分布动态。
● 中药材鉴别与质控:道地药材的“药效”与其内在化学成分及其分布密切相关。空间代谢组学可以成为鉴别真伪、评价质量的“黄金标准”。


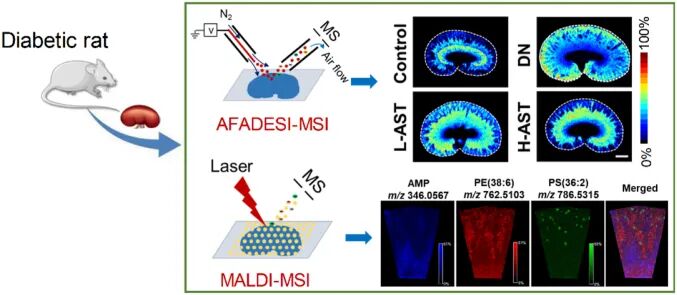
4药物研发与毒理学
● 药物安全性评价:发现药物在特定器官(如肝脏、心脏)中引起的局域性代谢紊乱,早期预警潜在的毒副作用。

如果你正在研究:
● 肿瘤异质性
● 神经退行性疾病
● 药物组织分布
● 器官特异性代谢
那么,空间代谢组与单细胞测序、空间转录组技术联用或许能为你带来下一个突破。
