
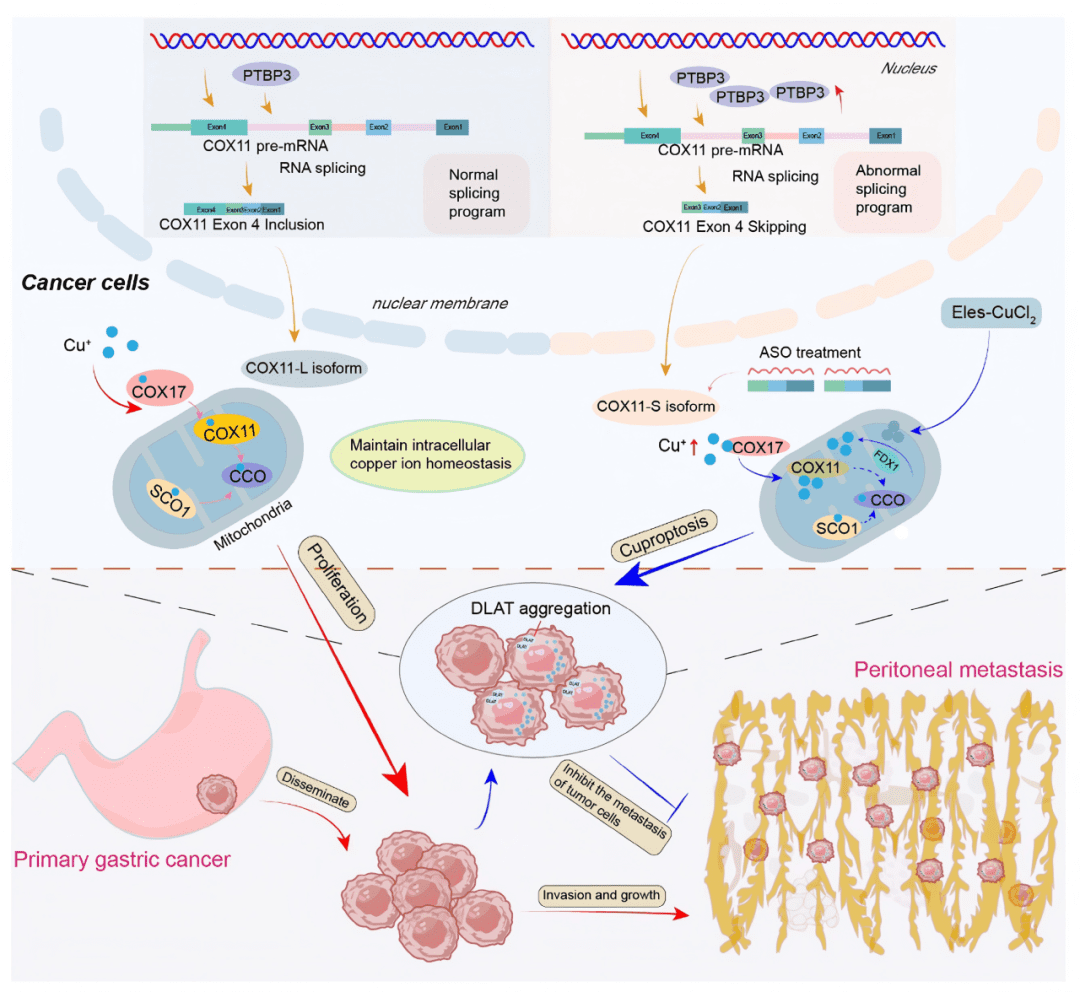
中文标题:靶向PTBP3介导的COX11选择性剪接诱导铜死亡以抑制胃癌腹膜转移
发表期刊:Advanced Science (Weinh)(Q1 IF=14.1)
发表时间:2025.4
研 究 解 读
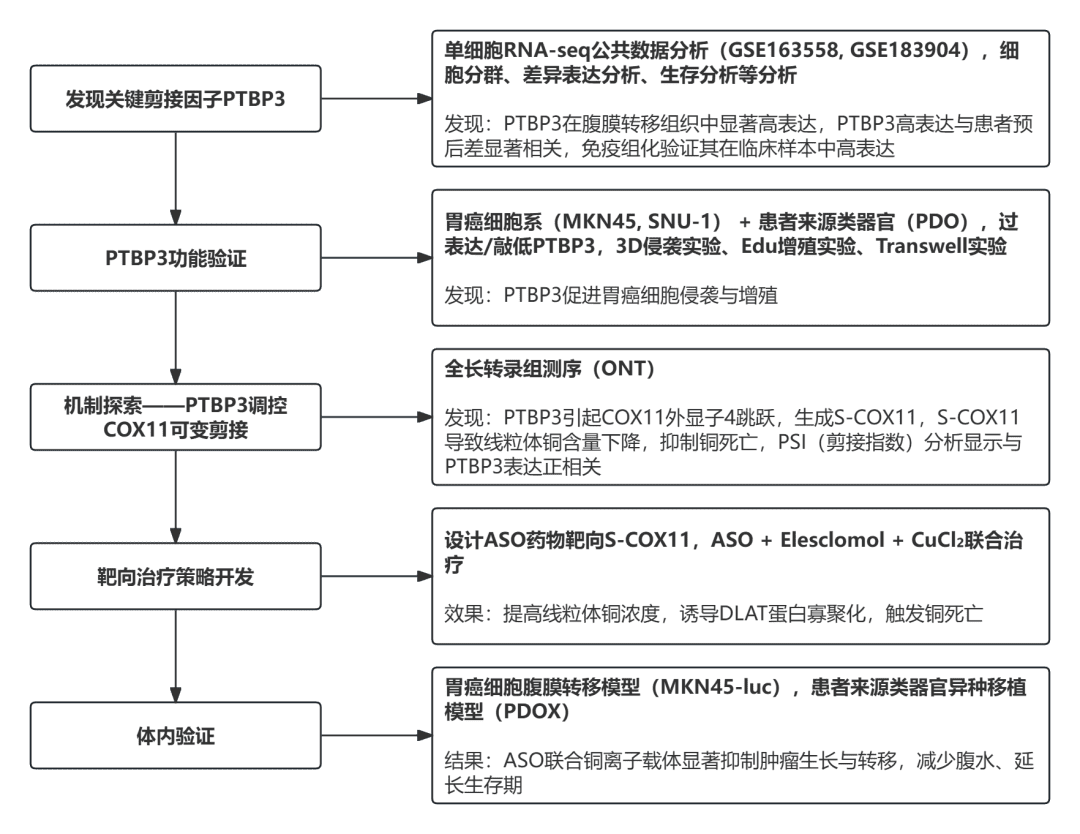
01 PTBP3在胃癌腹膜转移癌细胞中的过表达
○ 分析公共单细胞RNA-seq数据库(GSE163558, GSE183904)。
○ 使用患者来源类器官(PDO)模型进行验证。
○ 免疫组化(IHC)分析包含102对癌与癌旁组织和20例腹膜转移灶的组织芯片。
○ Western Blot、免疫荧光、生存分析。
关键结果:
○ 单细胞分析显示,与原发性胃癌相比,PTBP3在腹膜转移灶的肿瘤细胞中显著高表达(Fig. 1a-d)。
○ 转移来源的类器官(M-PDO)中PTBP3的mRNA和蛋白水平均高于原发来源的类器官(P-PDO)(Fig. 1f, h)。
○ 临床样本IHC证实,PTBP3在癌组织中的表达高于癌旁组织,在转移灶中的表达又显著高于原发灶(Fig. 1i, j)。
○ PTBP3高表达与患者总体生存期差显著相关,且与T分期和腹膜转移正相关(Fig. 1k)。
核心发现:
○ PTBP3是胃癌腹膜转移中一个关键的、与不良预后相关的过表达剪接因子,奠定了其作为研究靶点的临床相关性。
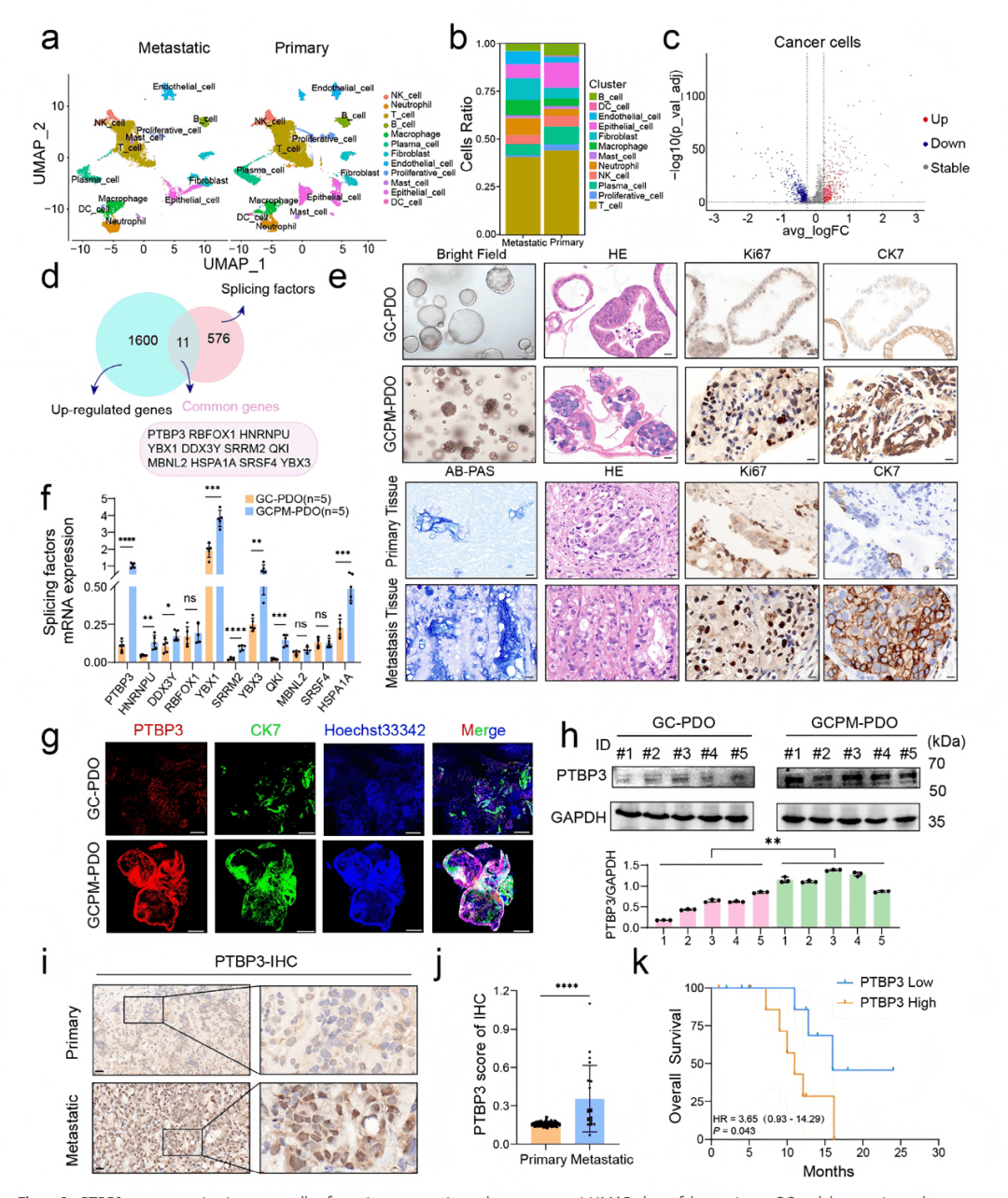
Fig.1
02 PTBP3促进胃癌细胞和类器官的侵袭与增殖
○ 在P-PDO中过表达PTBP3,在M-PDO中敲低PTBP3。
○ 在MKN45细胞(低表达PTBP3)中过表达PTBP3,在SNU-1细胞(高表达PTBP3)中敲除PTBP3。
○ 功能实验:3D Matrigel球体侵袭实验、EdU细胞增殖实验、Transwell实验。
关键结果:
○ 在类器官和细胞系中,过表达PTBP3能促进球体直径增大 (Fig. 2c-e, i, j)、EdU阳性细胞数增多 (Fig. 2m, n)、迁移和侵袭能力增强(Fig. S6g, h)。
○ 反之,敲低PTBP3则抑制了这些恶性表型,表现为表现为球体直径减小 (Fig. 2f-h, k, l)、EdU阳性细胞数减少 (Fig. 2o, p)、迁移和侵袭能力减弱 (Fig. S6i, j)。
核心发现:
○ PTBP3在功能上直接促进了胃癌细胞的侵袭、增殖和迁移能力,这些是腹膜转移的关键步骤。
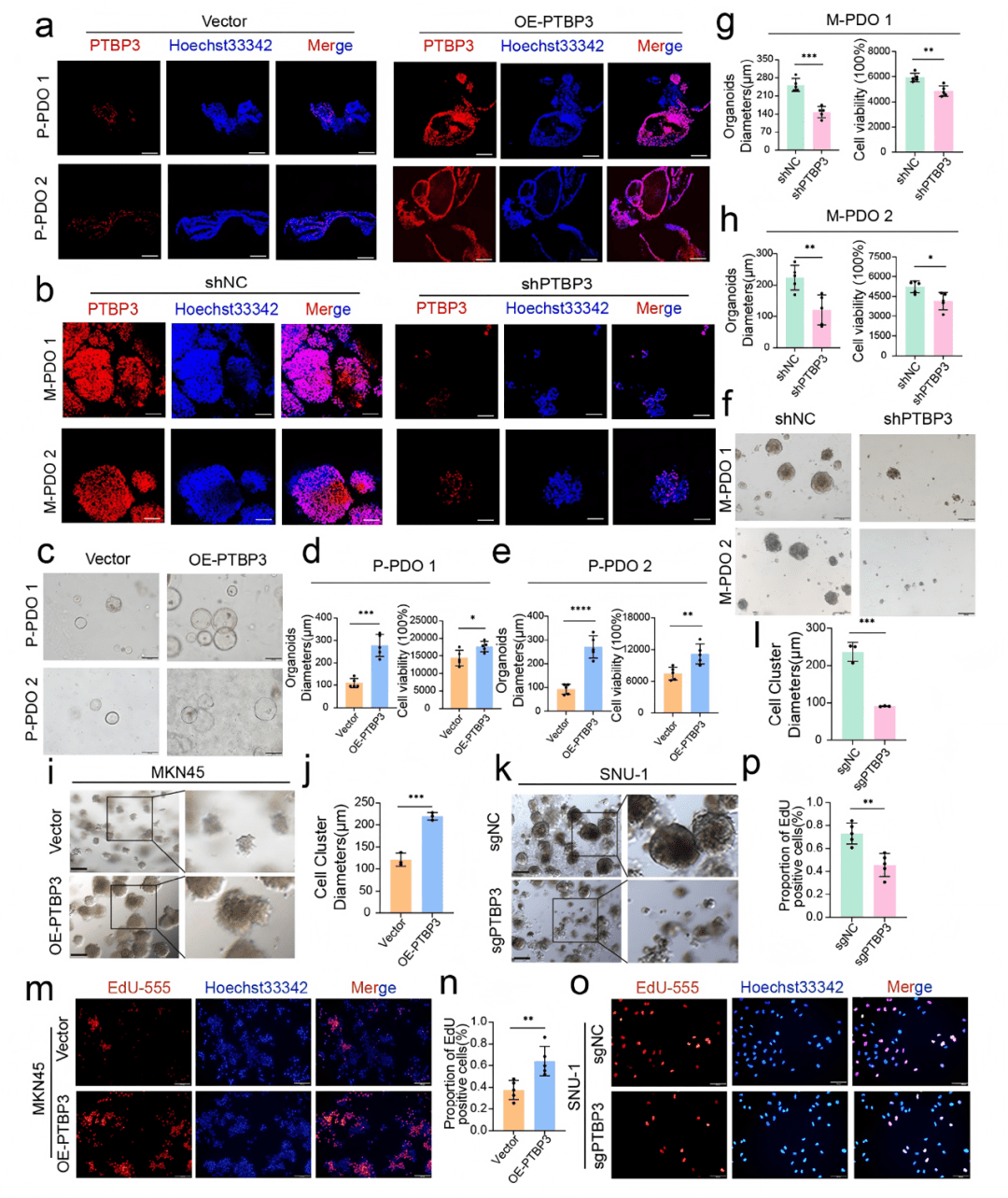
Fig.2
03 PTBP3在胃癌腹膜转移进程中调控剪接事件
○ 对PTBP3过表达和对照的MKN45细胞进行 Oxford Nanopore全长转录组测序。
○ 生物信息学分析:筛选差异剪接事件、KEGG/GSEA通路富集分析。
○ 实验验证:琼脂糖凝胶电泳、Sanger测序、RT-PCR 检测COX11转录本。
○ 临床样本中分析PSI(外显子包含率) 与PTBP3表达的相关性。
关键结果:
○ 全长测序发现,PTBP3主要引起外显子跳跃(Fig. 3b),并筛选出158个潜在靶基因(Data S2)。
○ 通路分析显示这些基因富集于代谢通路,特别是线粒体与TCA循环 (Fig. 3c, S7b, c)。
○ COX11被确定为关键下游靶点 (Fig. 3f),PTBP3导致其外显子4跳跃,产生短转录本 (Fig. 3h, i)。
○ 在转移灶中,COX11的PSI值更低(即短转录本比例更高)(Fig. 3k),且与PTBP3表达负相关 (Fig. 3j),与患者不良预后相关(Fig. S9c)。
核心发现:
○ PTBP3通过介导COX11 pre-mRNA的外显子4跳跃,导致功能性短转录本(S-COX11)的增加,这可能是其促进转移的核心机制。
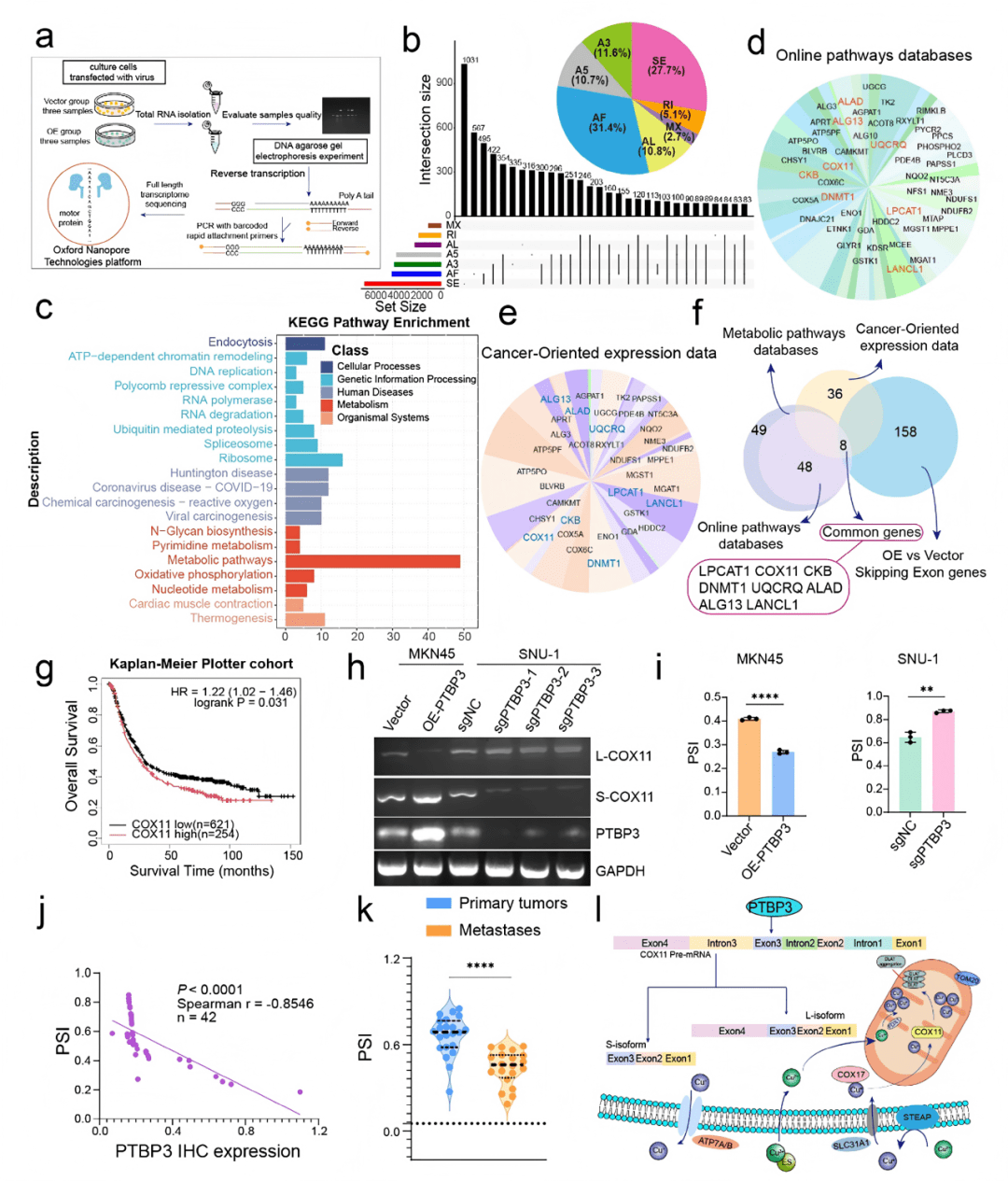
Fig.3
04 靶向S-COX11的ASO药物削弱胃癌细胞和类器官的增殖与侵袭能力
○ 设计合成2′-MOE修饰的反义寡核苷酸(ASO),特异性靶向S-COX11转录本。
○ 在PTBP3过表达或敲低的细胞和类器官中,进行ASO挽救实验。
○ 功能评估:3D球体形成实验、EdU实验、Transwell实验。
关键结果:
○ ASO能有效降解S-COX11 mRNA,而对长转录本影响较小 (Fig. S10b, c)。
○ 在PTBP3过表达的细胞中,ASO处理可以逆转由PTBP3带来的侵袭 (Fig. 4a, b)和增殖增强效应 (Fig. 4e, f)。
○ 在PTBP3敲低的细胞中,ASO能进一步抑制侵袭 (Fig. 4c, d) 和增殖 (Fig. 4g, h)。
核心发现:
○ PTBP3的功能在很大程度上依赖于S-COX11。靶向S-COX11的ASO药物能有效抑制肿瘤的恶性行为,证明了其作为治疗策略的可行性。
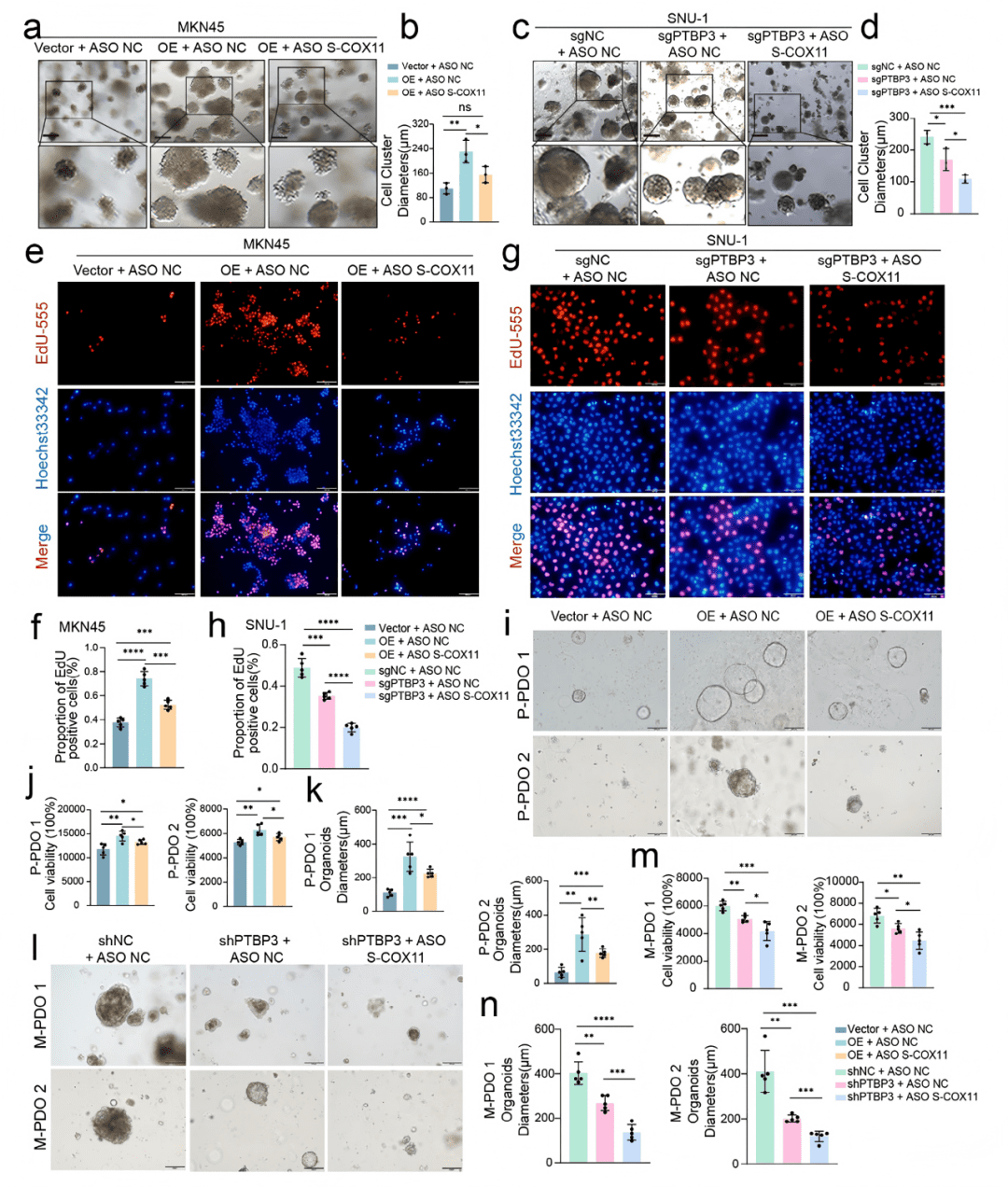
Fig.4
05 PTBP3调控的S-COX11增加增强小鼠胃癌腹膜转移
○ 构建体内腹膜转移模型:将荧光素酶标记的MKN45细胞(对照组/PTBP3过表达组)注射入裸鼠腹腔。
○ 实验组注射ASO药物。
○ 监测指标:活体成像监测肿瘤生长、肿瘤结节计数、腹水量、小鼠体重、组织学分析(H&E, IHC)。
关键结果:
○ PTBP3过表达组小鼠的肿瘤负荷 (Fig. 5b, c)、腹水 (Fig. 5f)、腹膜结节数量 (Fig. 5d, e) 均显著增加。
○ ASO治疗显著抑制了PTBP3过表达所导致的肿瘤生长 (Fig. 5b, c) 和转移 (Fig. 5d-f)。
○ IHC和RT-PCR证实,ASO处理降低了肿瘤组织中S-COX11的水平(Fig. 5j, k)。
核心发现:
○ PTBP3通过增加S-COX11促进胃癌腹膜转移,而靶向S-COX11的ASO在体内具有显著的治疗效果。
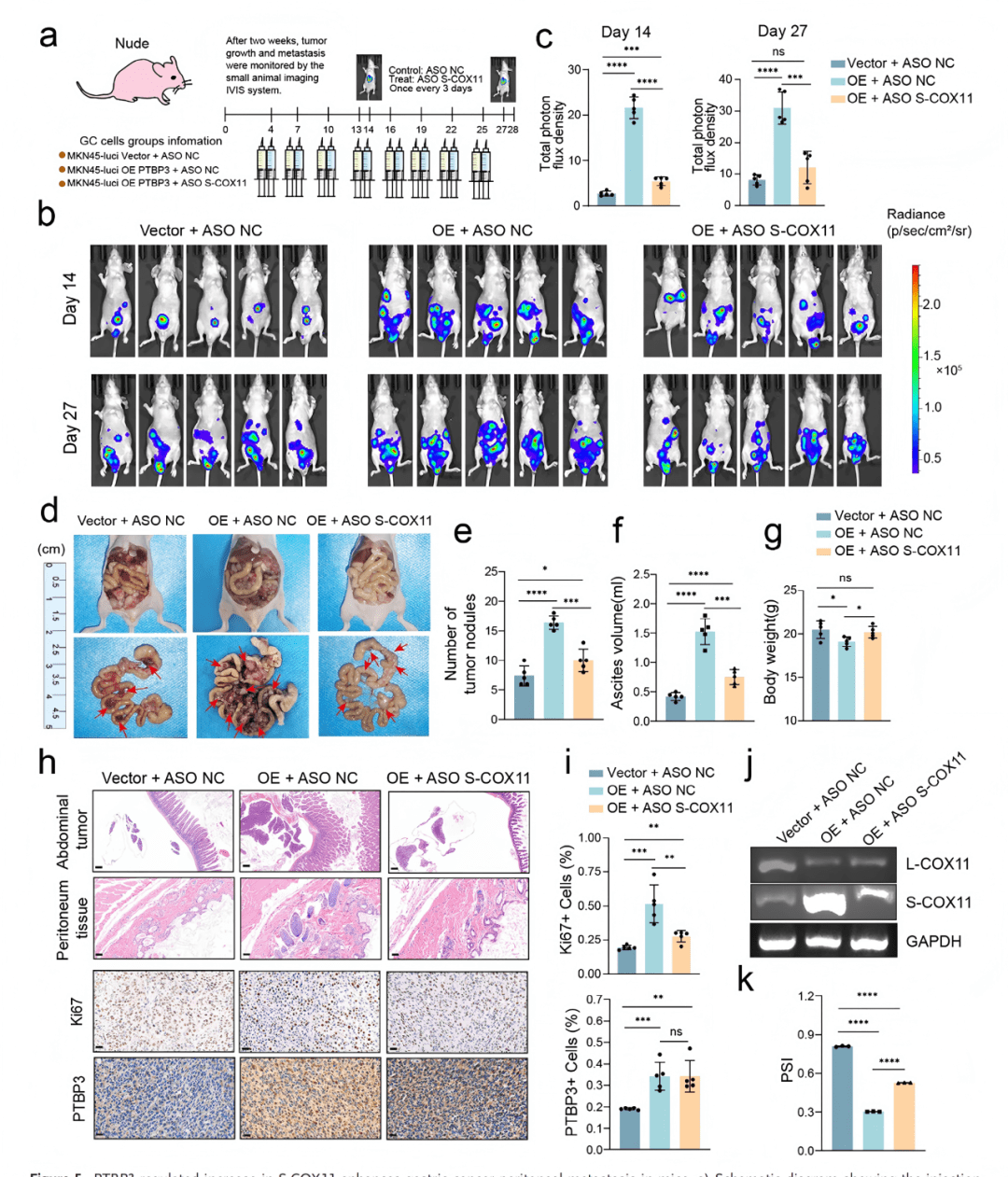
Fig.5
06 靶向S-COX11的ASO药物增加内源性铜浓度
○ 使用铜离子荧光探针检测线粒体内铜浓度。
○ 联合使用铜离子载体Elesclomol(Eles)和CuCl₂。
○ 透射电镜观察线粒体形态,MitoTracker 标记线粒体。
○ 免疫荧光和Western Blot 检测铜死亡关键指标:DLAT蛋白的寡聚化和脂酰化水平。
关键结果:
○ PTBP3过表达导致线粒体铜水平略有下降,而ASO处理能显著提升线粒体铜浓度,尤其在Eles/CuCl₂存在下效果更显著 (Fig. 6d)。
○ ASO联合Eles/CuCl₂处理导致线粒体空泡化、功能受损 (Fig. 6f, g)。
○ ASO联合Eles/CuCl₂处理诱导了DLAT的显著寡聚化 (Fig. 6h, i),这是铜死亡的直接证据。该过程依赖于FDX1(Fig. 6i, S12b)。
核心发现:
○ 靶向S-COX11的ASO通过破坏由PTBP3异常剪接建立的铜稳态,使肿瘤细胞对铜死亡敏感。 当与铜离子载体联用时,能协同诱导强烈的铜死亡。
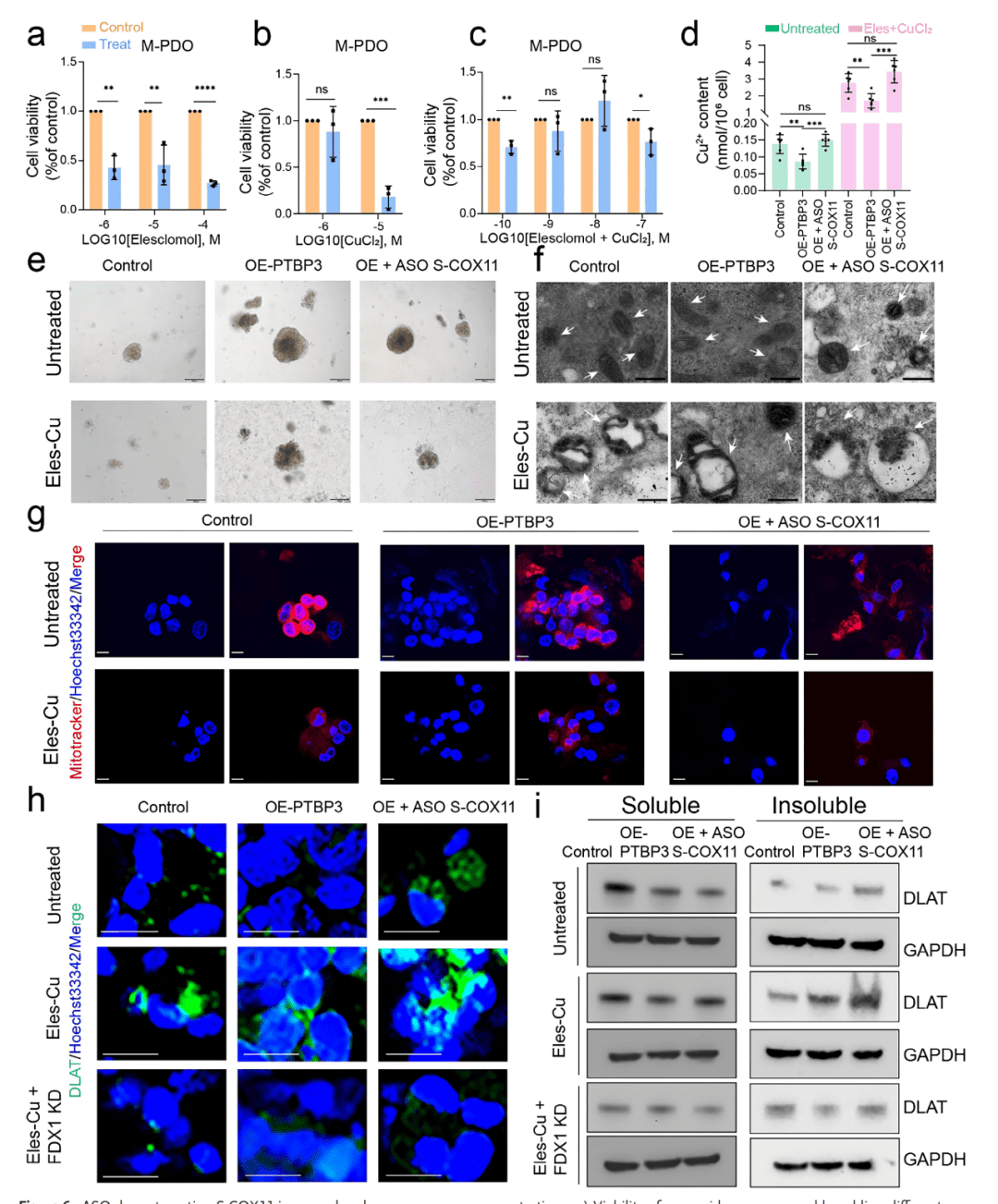
Fig.6
07 靶向S-COX11的ASO药物联合Elesclomol在PDOX模型中诱导铜死亡
○ 建立患者来源类器官异种移植(PDOX)模型,模拟人体内肿瘤微环境。
○ 设置四组治疗:对照组、ASO单药组、Eles/CuCl₂组、ASO+Eles/CuCl₂联合组。
○ 评估:肿瘤体积/重量、IHC(Ki67, PTBP3, 脂酰化蛋白)、免疫荧光(TOM20)、组织铜染色。
关键结果:
○ 联合治疗组显示出最强的肿瘤抑制效果 (Fig. 7b-d)。
○ IHC显示联合治疗组细胞增殖(Ki67)显著降低 (Fig. 7e, f),脂酰化DLAT蛋白水平下降(表明其发生寡聚而被消耗)(Fig. 7e, h, S13b)。
○ 免疫荧光显示联合治疗组线粒体膜蛋白TOM20信号减弱,表明线粒体损伤 (Fig. 7e, i)。
○ 组织铜染色显示联合治疗组铜离子积累最明显(Fig. 7e)。
核心发现:
○ 在高度模拟临床的PDOX模型中,ASO联合铜离子载体能够通过诱导铜死亡,有效抑制胃癌腹膜转移瘤的生长,为临床转化提供了强有力的 preclinical 证据。
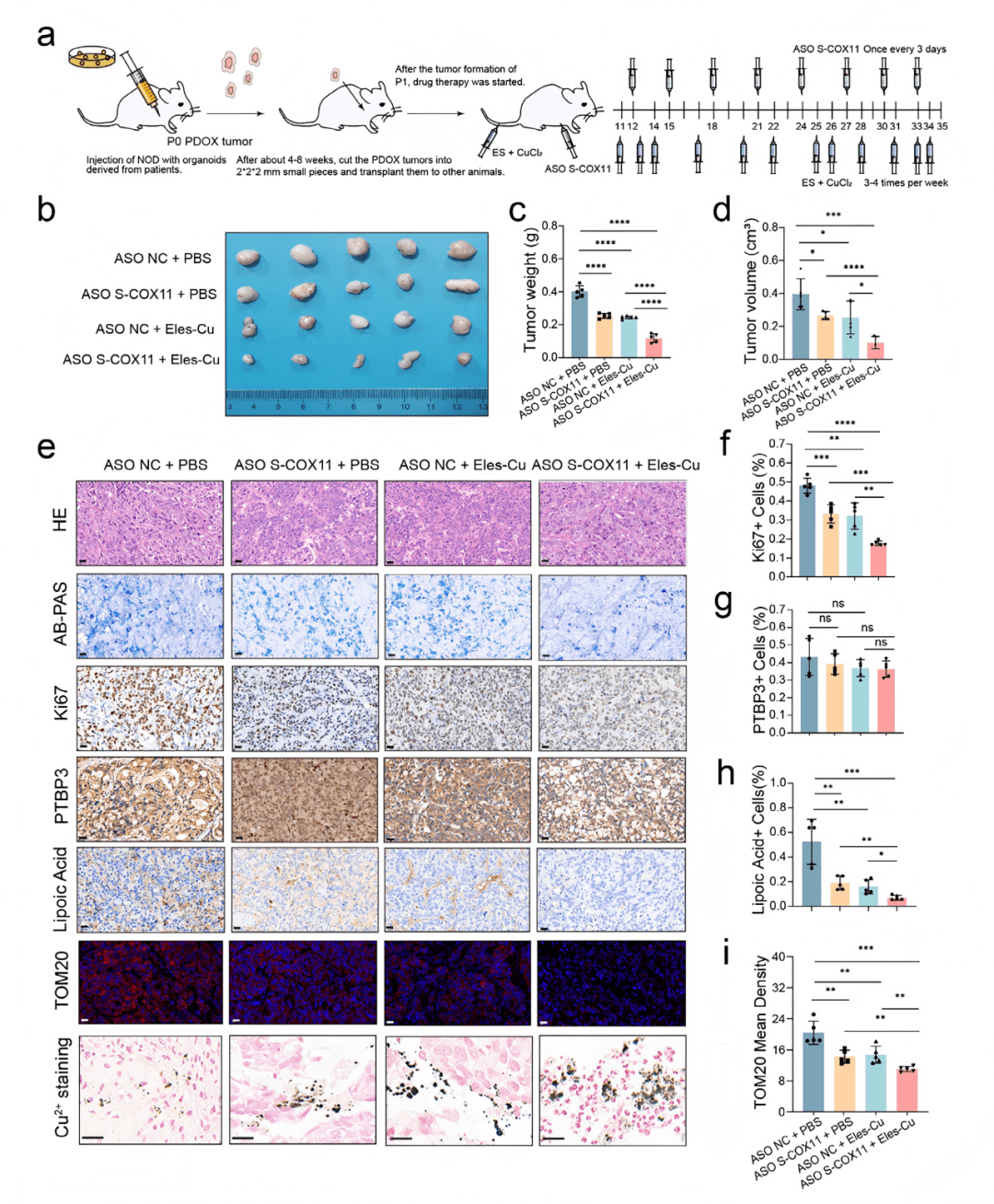
Fig.7
研 究 总结
价值:从复杂的组织微环境中,低成本、高效率地筛选与表型最相关的关键细胞群体及分子靶点。
我们的服务:我们提供专业的单细胞公共数据挖掘服务,助您从海量数据中淘得“真金”,快速锁定研究方向。「单细胞大数据」产品重磅上线!瑞兴十年磨剑,助力数据高效转化产出成果!
价值:在在锁定上游调控因子后,直接、全面地揭示其下游的转录本结构与剪接调控全景。
我们的服务:我们拥有成熟的Oxford Nanopore全长转录组测序与生信分析平台,可为您提供从剪接事件发现到功能预测验证的一站式解决方案。三代长读长RNA测序,我可以获得哪些创新发现?
手握单细胞数据,不知如何深度挖掘?
找到了关键基因,却卡在机制研究上?
希望探索可变剪接,但传统测序手段力不从心?
我们愿以专业的技术服务,成为您科研道路上最可靠的合作伙伴。
