RXBio Translates Sequence to Science and Industry
Tel: 027-87050299Email: sales@rxbio.cc
RXBio Translates Sequence to Science and Industry
脂质(Lipid):是一种可溶于非极性溶剂的生物分子,包括脂肪、固醇、脂溶性维生素(如维生素A、D、E和K)、单甘油酯、双甘油酯、甘油三酯、鞘脂和磷脂等等。主要生物功能包括细胞屏障、信号传导、物质传输、能量储存等,在生命活动中起着非常重要的作用。
脂质组学(Lipidomics):研究脂质的结构、功能、相互作用,与其他代谢物、蛋白的相互作用以及对机体整体系统生理病理状态的影响。
广泛靶向脂质组:结合非靶脂质“广覆盖””和靶向脂质“准确稳定”的双重优势,一次性稳定检测上千种脂质。覆盖FA、PC、PEPS、PA、PI、PG、LPA、LPC、LPE、LPG、LPS、CE、Cer、HexCer、DG、TG、MG、类花生酸、酰基肉碱等多类脂质。
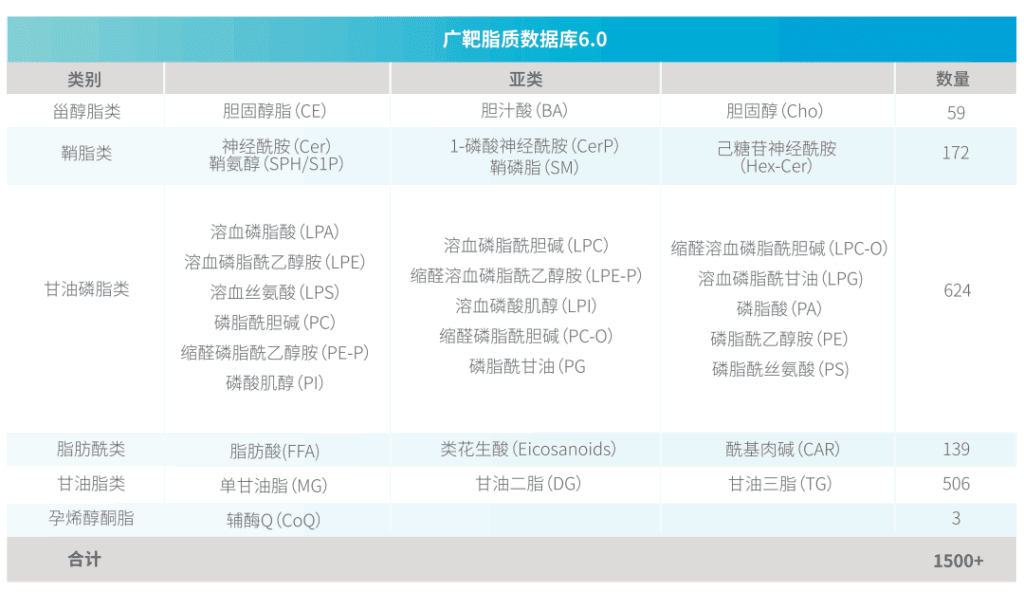
✔ 高通量:可一次性检测上千种脂质
✔ 广覆盖:同时覆盖FA、PC、PEPS、PA、PI、PG、LPA、LPC、LPE、LPG、LPS、CE、Cer、HexCer、DG、TG、MG、类花生酸、酰基肉碱等多类脂质。
✔ 重现性:多次检测结果有更好的重现性,有效提高后期数据验证成功率
✔ 高灵敏:采用高灵敏度质谱仪AB SCIEX6500+,检测下限低至pg级
✔ 高特异:采用MRM模式,特异性的靶向检测千种脂质

英文题目:Qige Decoction attenuated non-alcoholic fatty liver disease through regulating SIRT6-PPARα-mediated fatty acid oxidation
中文题目:奇歌汤通过调节 SIRT6-PPARα 介导的脂肪酸氧化减轻非酒精性脂肪肝疾病
期刊:Phytomedicine(双一区,IF=6.7)
发表时间:2025.3
DOI:10.1016/j.phymed.2025.156395
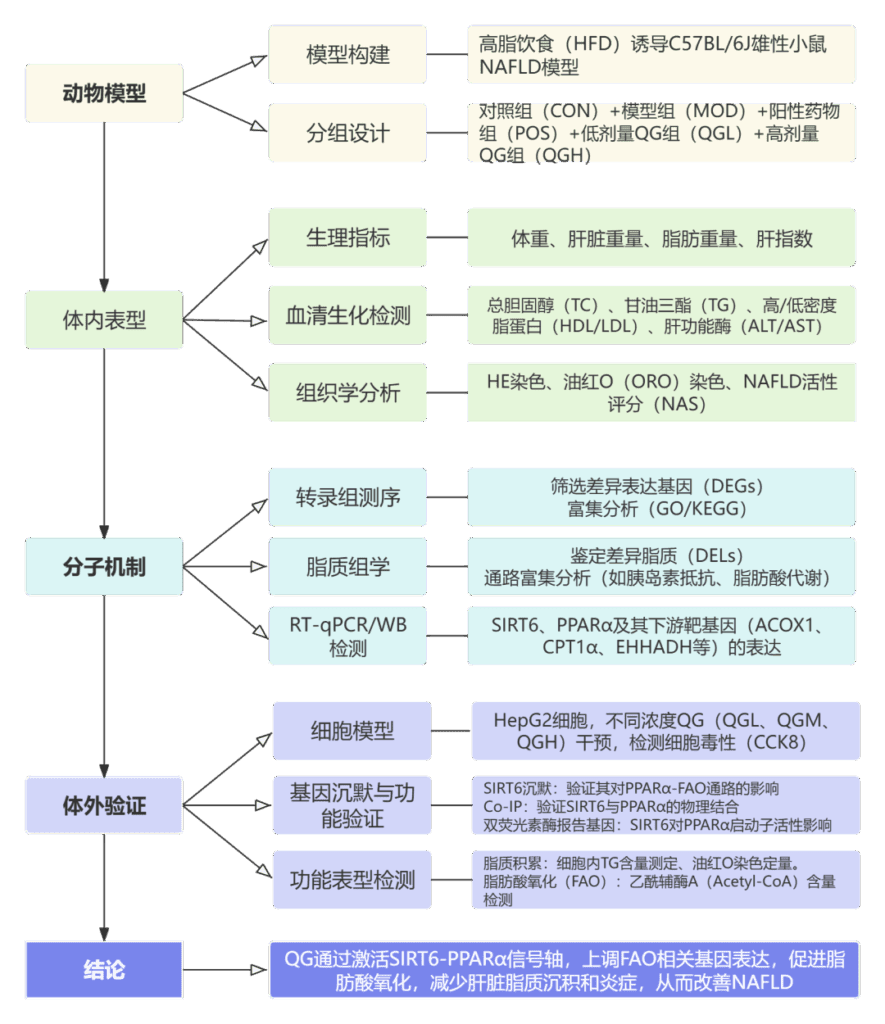
背景: Sirtuin 6 (SIRT6) 是非酒精性脂肪性肝病 (NAFLD) 的潜在治疗靶点,已被证明通过与过氧化物酶体增殖物激活受体 α (PPARα) 相互作用来调节脂肪酸氧化 (FAO)。然而,SIRT6-PPARα 通路对 NAFLD 表型的影响尚未报道。奇格汤 (QG) 是一种中医 (TCM) 配方,广泛用于治疗糖脂代谢紊乱。我们之前的实验表明,QG 减少了肝脂肪变性,并提供了 QG 可能促进 FAO 的初步证据。然而,对 QG 调节 FAO 的分子机制的透彻理解需要进一步研究。
目的: 探讨 SIRT6-PPARα 信号通路对 NAFLD 表型的作用,探讨 QG 改善 NAFLD 的机制及其与 SIRT6-PPARα 信号通路调控的 FAO 的关系。
方法: 体内研究将高脂饮食 (HFD) 诱导的 NAFLD 小鼠分为两部分。第一部分涉及四组:对照组 (CON) 、模型组 (MOD) 、PPARα 激动剂 (WY-14,643, WY) 和 SIRT6 抑制剂 (OSS-128,167, OS) 组。第二部分涉及 CON 组、MOD 组、阳性药物 (POS) 组、低剂量 QG (QGL) 组和高剂量 QG (QGH) 组。通过 UHPLC-QTOF/MS 进行广靶脂质组学分析肝脏中的差异脂质 (DEL),同时在 Illumina 测序平台上通过转录组分析分析差异表达基因 (DEGs)。体外研究,采用免疫共沉淀和双荧光素酶测定进一步确定 SIRT6-PPARα 相互作用的分子机制。采用慢病毒载体、TG 测定和乙酰辅酶 A 测定阐明 SIRT6-PPARα 信号通路在体外 QG 改善脂质积累中不可或缺的作用。
结果: SIRT6 的下调抑制了 PPARα 介导的 FAO,并加剧了体内和体外肝细胞中的脂质积累。SIRT6 与 HepG2 细胞中的 PPARα 结合;然而,未检测到 PPARα 启动子的 SIRT6 激活。随着 QG 减少肝细胞脂质积累,SIRT6-PPARα 信号通路在体内和体外均上调。然而,QG 对脂质积累的缓解作用被体外沉默 SIRT6 阻断。
结论: 本研究证实 SIRT6-PPARα 信号通路抑制加剧了 NAFLD 血脂异常和肝脂肪变性。此外,本研究首次深入分析了 QG 改善 NFALD 的分子机制,涉及通过激活 SIRT6-PPARα 信号通路促进 FAO。本研究为 QG 的临床应用提供了重要的见解。

电话:027-870502099
邮箱:sales@rxbio.cc
地址:武汉市东湖高新区高新二路388 号
光谷生物医药加速器 18 栋 1-2层
单细胞多组学 空间转录组
三代测序 功能基因组
表观遗传学 互作组学
单细胞大数据 数据深度挖掘

欢迎关注公众号「瑞兴生物」