RXBio Translates Sequence to Science and Industry
Tel: 027-87050299Email: sales@rxbio.cc
RXBio Translates Sequence to Science and Industry
单细胞三代全长转录组测序融合了单细胞分辨率与全长转录本覆盖的双重优势,旨在揭示传统测序技术难以捕捉的细胞功能多样性、转录调控机制及疾病相关变异。
传统单细胞测序(如10x Genomics 3’或5’端测序)仅能捕获转录本末端片段,存在以下局限:
① 异构体盲区:无法区分同一基因的不同剪接变体(如选择性启动子、外显子跳跃),而这些异构体可能具有相反功能(如促癌型与抑癌型)。
② 复杂结构变异遗漏:融合基因的全长结构难以精准组装。
单细胞三代全长转录组测序的突破在于:
✔ 全长覆盖:直接读取转录本从5’帽到3’尾的完整序列,精确解析剪接位点、UTR变异及RNA编辑事件。
✔ 单分子分辨率:独立分析每个细胞的转录组,避免因群体平均化掩盖稀有细胞类型(如癌症干细胞或免疫应答细胞)。
全长转录组数据为理解基因表达调控提供了多层级信息:
① 启动子与终止子多样性:同一基因使用不同启动子可产生功能迥异的蛋白(如p53异构体的促凋亡或促存活功能)。
② 可变剪接调控机制:通过分析单细胞水平的剪接因子活性,揭示细胞状态转换的分子开关(如胚胎发育中Wnt通路异构体的动态变化)。
在临床和转化研究中,单细胞三代全长转录组测序正成为不可替代的技术:
① 癌症异质性解析:鉴定肿瘤微环境中促转移的特定剪接变体(如CD44v6促进EMT)及耐药性相关的新融合基因亚型(如BCR-ABL1)。
② 罕见病诊断:直接检测单细胞中因剪接错误导致的隐性致病变异(如脊髓性肌萎缩症SMN1/2外显子跳跃)。
③ 免疫治疗优化:解析T细胞受体(TCR)的全长多样性,预测免疫检查点抑制剂响应。
单细胞三代全长转录组测序技术基于10x Genomics单细胞捕获平台与Oxford Nanopore长读长测序技术构建,不仅可解析单个细胞的基因表达全景,还能精准捕获mRNA的完整结构信息。该技术通过整合单细胞技术与三代长读长测序的优势,将单细胞转录组分析从基因表达水平推进至转录本异构体层面。
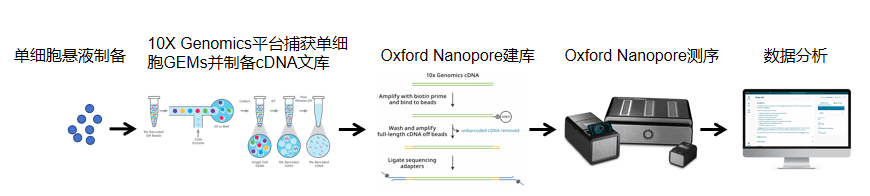
✔ 全面转录异构体分析:精确剖析所有异构体类型,提供完整信息呈现。
✔ 融合基因全景解析:全方位解码融合基因,揭示其整体特征。
✔ 细胞亚群的精细化分类:获取更精确的细胞细分群体,提高研究结果的准确性。
✔ 实时监控可变剪切:即时追踪变化动态,把控演变过程。
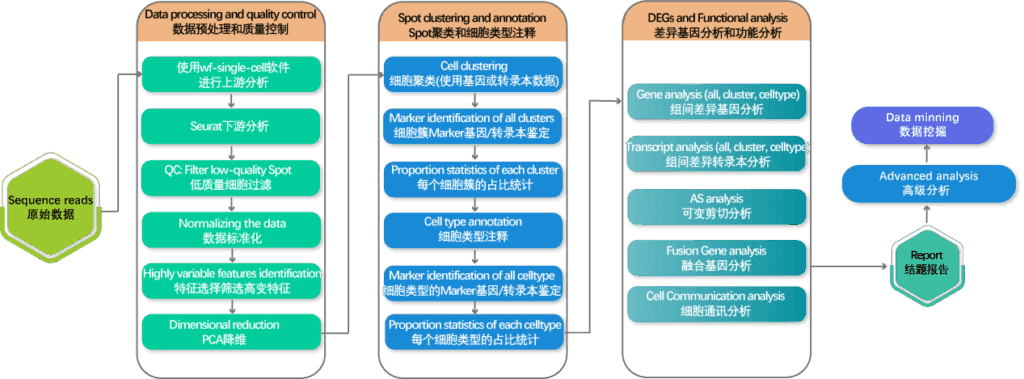
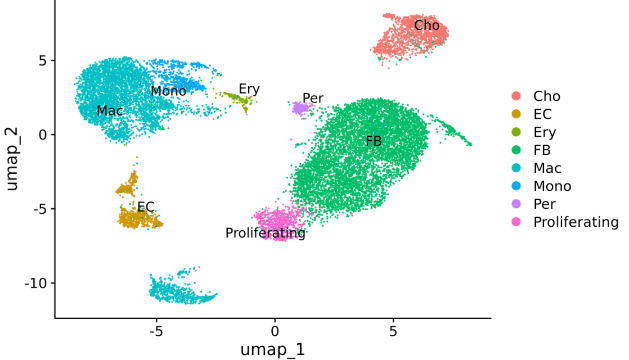
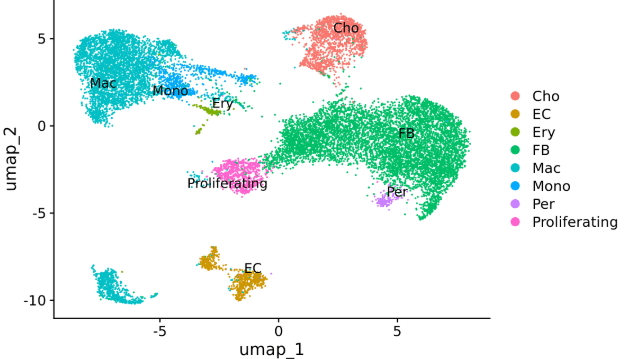
样本:小鼠肺组织
单细胞平台:10X 3ʹ v3
三代平台:Oxford Nanopore
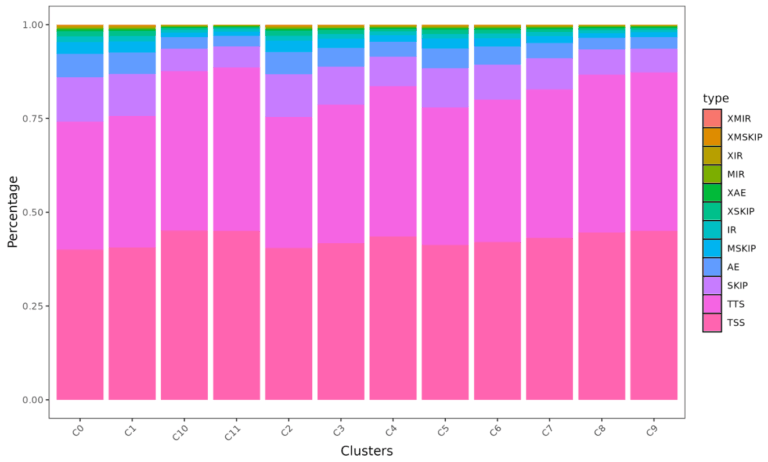
Title:Single-cell long-read sequencing-based mapping reveals specialized splicing patterns in developing and adult mouse and human brain
中文标题:基于单细胞长读长测序的图谱揭示了发育中和成年小鼠和人脑中的特化剪接模式
期刊:Nature Neuroscience
影响因子:20
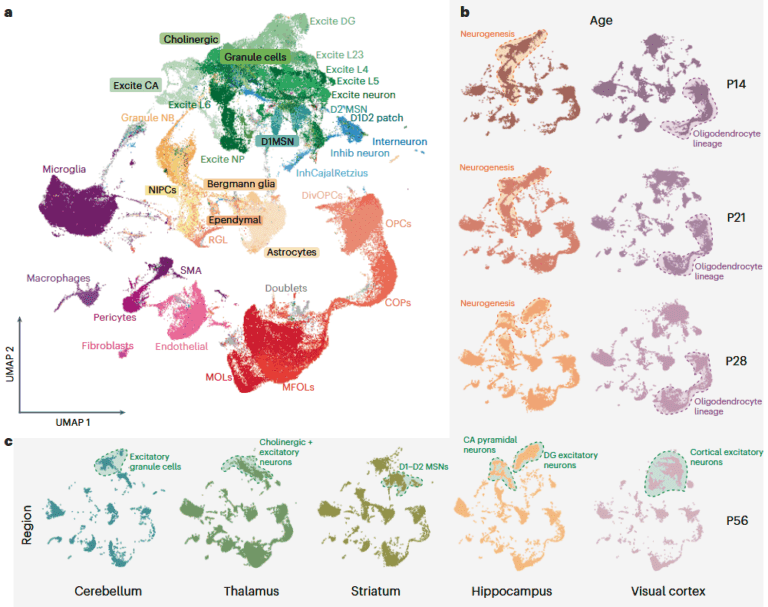
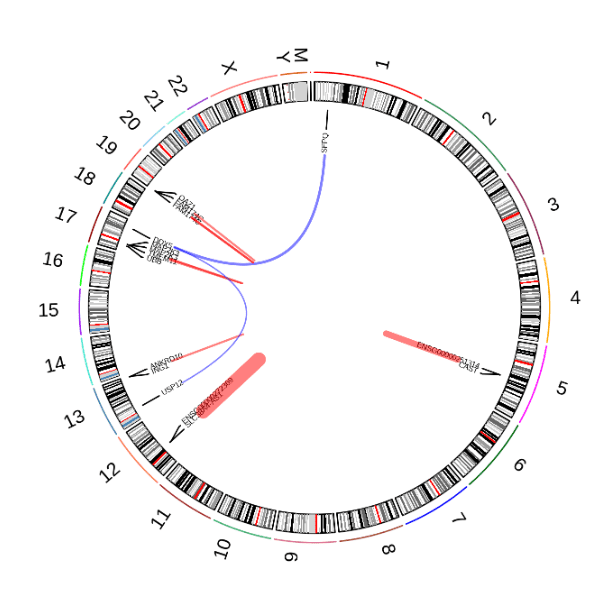
样本情况:
涵盖不同发育阶段(P14、P21、P28和P56)和多个脑区(海马体、视觉皮层、纹状体、丘脑、小脑)的小鼠样本,同时也获取了6份健康人类大脑样本(包括海马体,其中三男三女)。
研究发现:
1. 剪接多样性的广泛存在
• 72% 的基因在至少一个维度(细胞亚型、脑区、发育阶段)中存在全长异构体表达差异,其中神经元的异构体变异性高于神经胶质细胞和祖细胞,表明神经元调控更复杂。
• 细胞类型特异性剪接模式显著,例如兴奋性神经元的异构体变异性主要体现在亚型间,而抑制性神经元在年龄和脑区间差异更明显。
2. 区域和发育阶段的剪接特征
• 脑区特异性:丘脑和小脑的星形胶质细胞表现出强烈的转录起始位点(TSS)、多聚腺苷酸化(poly (A))位点和外显子调控差异,提示剪接对脑区形态和功能的重要影响。
• 发育调控:青春期(P21-P28)是剪接变异性的关键过渡期,此时细胞类型间的外显子 inclusion 变异性标准差最高,且突触相关基因的剪接模式发生显著变化。
3. 物种间的剪接保守性与特异性
• 小鼠细胞类型特异性剪接在人类海马体中大部分保守(如 E3 和 E5 组的极可变外显子),但人类大脑存在额外的细胞类型特异性剪接,可能代表进化获得的功能异构体。
4. 剪接与功能及疾病的关联
• 极可变外显子(EVExs)影响蛋白质结构域(如纤维连接蛋白 III 型结构域),参与细胞识别和信号传导,与神经元功能密切相关。
• 20% 的 EVExs 受 RNA 结合蛋白(RBPs)调控,16% 的 EVExs 与已知的剪接数量性状位点(sQTL)相关,且多数涉及神经疾病(如阿尔茨海默病、精神分裂症)。
5. 胶质细胞的剪接特征
• 少突胶质细胞谱系的剪接模式在分化过程中发生显著转变,与基因表达模式不一致,提示剪接在细胞身份建立中具有独立作用。
核心结论:
剪接多样性在细胞亚型、脑区和发育阶段中广泛存在,是塑造脑功能特化和细胞身份的关键机制,且部分模式在人与小鼠间保守。这些发现为理解脑发育、功能及神经疾病的分子机制提供了新视角。
Title:Detection of isoforms and genomic alterations by high-throughput full-length single-cell RNA sequencing in ovarian cancer
中文标题:通过高通量全长单细胞 RNA 测序检测卵巢癌中的亚型和基因组改变
期刊:Nature Communications
影响因子:15.7
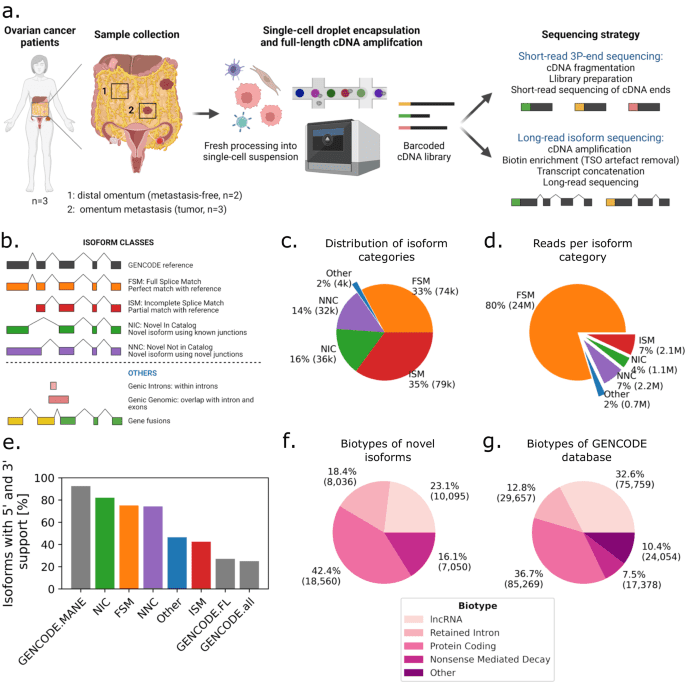
样本情况:
3 例高级别浆液性卵巢癌(HGSOC)患者的 5 份网膜活检样本,包括 3 份网膜转移灶样本和 2 份匹配的远端无肿瘤网膜组织样本。
研究发现:
1. 异构体多样性与新亚型鉴定
• 共检测到 152,546 种异构体,其中 52,884 种为未报道的新异构体(占比 34.7%),42% 的新异构体为蛋白编码型,高于 GENCODE 数据库的 36%。
• 肿瘤细胞中异构体多样性显著增加,含新连接(neojunction)的异构体占比是其他细胞类型的 2.3-10.6 倍,且 8% 的肿瘤特异性异构体为单细胞独有。
• 基因水平分析发现,蛋白编码基因表达中约 20% 实际为非编码异构体,导致短读长数据对蛋白表达的高估。
2. 肿瘤微环境(TME)的上皮 – 间质转化(EMT)机制
• 网膜转移灶中,间皮细胞通过 TGF-β/miR-29 / 胶原轴转化为癌相关成纤维细胞(CAFs):TGF-β 上调导致 miR-29 沉默,解除对 COL1A1、COL3A1 等胶原基因的抑制,同时胶原基因 3’UTR 延长增强表达。
• 转移灶间皮细胞中,COL1A1 的 canonical 异构体表达量是癌旁组织的 62 倍,且通过选择性多聚腺苷酸化(APA)使用 distal 位点,避免 miR-29 介导的沉默。
3. 基因组变异与融合基因检测
• 成功识别出 TP53 等基因的体细胞突变及胚系突变,与靶向 NGS 结果一致。
• 发现患者特异性 IGF2BP2::TESPA1 融合基因,在短读长数据中被误判为 TESPA1 高表达,而长读长数据证实其为肿瘤细胞特异性融合,涉及 IGF2BP2 的 RNA 识别域与 TESPA1 的 3’UTR,可能通过激活 IGF 通路促进肿瘤发生。
4. 异构体开关与临床意义
• 960 个基因(15.1%)在肿瘤与正常组织中存在异构体使用差异(相对丰度变化 > 20%),其中 36% 伴随生物型转换(如蛋白编码→非编码)。
• IGF1 在肿瘤细胞中从内源型(Class I)切换为分泌型(Class II),可能通过 IGF1R 激活 EMT;RTN1-C 异构体在患者 3 中高表达,可能通过结合 Bcl-xL 促进凋亡抵抗。
核心结论:
长读长单细胞测序揭示了卵巢癌中异构体多样性、TME 重塑及基因组变异的单细胞分辨率特征,为精准分型、转移机制及靶向治疗(如 IGF2BP2::TESPA1 融合)提供了新视角。

电话:027-870502099
邮箱:sales@rxbio.cc
地址:武汉市东湖高新区高新二路388 号
光谷生物医药加速器 18 栋 1-2层
单细胞多组学 空间转录组
三代测序 功能基因组
表观遗传学 互作组学
单细胞大数据 数据深度挖掘

欢迎关注公众号「瑞兴生物」